
【题目】实验室制氯气可用软锰矿和浓盐酸反应。
(1)写出该反应的离子方程式:_______________________________,若反应中生成11.2L的Cl2(标准状况),则被还原的盐酸的物质的量是______。
(2)实验室用下列两种方法制取氯气:①用含HCl 146g 的浓盐酸与足量的MnO2反应②用87g MnO2与足量的浓盐酸反应,则所得Cl2______。
A.①比②多 B.②比①多 C.一样多 D.无法比较
(3)实验室制氯气中收集干燥纯净的氯气可将气体先通过______,再通过______,氯气尾气吸收可用__________溶液,发生反应的离子方程式是____________。
【答案】 MnO2 + 4H+ + 2Cl-![]() Mn2+ + 2H2O + Cl2 1 mol B 饱和食盐水 浓硫酸 NaOH Cl2 + 2OH- == Cl- + ClO- + H2O
Mn2+ + 2H2O + Cl2 1 mol B 饱和食盐水 浓硫酸 NaOH Cl2 + 2OH- == Cl- + ClO- + H2O
【解析】(1)实验室可用软锰矿和浓盐酸反应制氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,根据元素化合价的变化分析解答;
MnCl2+Cl2↑+2H2O,根据元素化合价的变化分析解答;
(2)由MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,但随着反应的进行,盐酸的浓度减小,反应不再进行,据此分析判断;
MnCl2+Cl2↑+2H2O,但随着反应的进行,盐酸的浓度减小,反应不再进行,据此分析判断;
(3)制得的氯气中含有水蒸气和氯化氢,结合二者的性质分析除去的方法,氯气有毒,直接排放会污染空气,需要尾气处理,常用氢氧化钠溶液吸收。
(1)实验室可用软锰矿和浓盐酸反应制氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子方程式为MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O,离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,11.2L的Cl2(标准状况)的物质的量为
Mn2++Cl2↑+2H2O,11.2L的Cl2(标准状况)的物质的量为![]() =0.5mol,氯气中氯原子全部离子与被氧化的氯化氢,被氧化的氯化氢为1mol,故答案为:MnO2+4H++2Cl-
=0.5mol,氯气中氯原子全部离子与被氧化的氯化氢,被氧化的氯化氢为1mol,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;1mol;
Mn2++Cl2↑+2H2O;1mol;
(2)由MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,可知87g二氧化锰与146gHCl恰好完全反应,但随着反应的进行,盐酸的浓度减小,反应不再进行,①中HCl不能完全反应,②中二氧化锰完全反应,故生成氯气的体积②>①,故答案为:B;
MnCl2+Cl2↑+2H2O,可知87g二氧化锰与146gHCl恰好完全反应,但随着反应的进行,盐酸的浓度减小,反应不再进行,①中HCl不能完全反应,②中二氧化锰完全反应,故生成氯气的体积②>①,故答案为:B;
(3)制得的氯气中含有水蒸气和氯化氢,需要首先通过饱和的食盐水,除去氯化氢,在通过浓硫酸干燥,除去水蒸气;氯气有毒,可污染空气,要进行尾气吸收,常用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:饱和食盐水;浓硫酸;NaOH;Cl2 + 2OH- = Cl- + ClO- + H2O。


科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
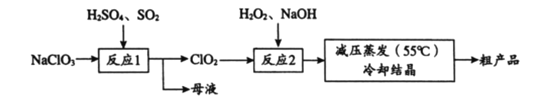
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平衡体系Ca(OH)2(s)![]() Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
A. 加入少量MgCl2固体 B. 加入少量Na2CO3固体
C. 加入少量KCl固体 D. 加入少量稀H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A. Na2CO3![]() 2Na++CO32- B. Ba(OH)2
2Na++CO32- B. Ba(OH)2![]() Ba2++2OH—
Ba2++2OH—
C. H2SO4![]() 2H++SO42- D. KClO3
2H++SO42- D. KClO3![]() K++Cl-+3O2-
K++Cl-+3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列判断正确的是
A.在18g18O2中含有NA个氧原子
B.22.4LCO2含有的共价键数目是4NA
C.1molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼铁高炉中存在以下热化学方程式:
Ⅰ.C(s) +CO2(g)==2CO(g) ΔH1=+172.5 kJ·mol-1
Ⅱ.Fe2O3(s) +CO(g)![]() 2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
Ⅲ.FeO(s)+CO(g) ![]() Fe(s) +CO2(g) ΔH3=-11 kJ·mol-1
Fe(s) +CO2(g) ΔH3=-11 kJ·mol-1
Ⅳ. Fe2O3(s) +3CO(g) ![]() 2Fe (s)+3CO2(g) ΔH4
2Fe (s)+3CO2(g) ΔH4
(1)上述反应中,ΔH4=__________ kJ·mol-1。
(2)在实际生产中炼铁高炉中通人适量的空气,其主要作用是__________________。
(3)T℃时,在1L的密闭容器中加入20.0g Fe2O3和3.6gC,只发生反应:2 Fe2O3(s) +3C(s) ![]() 4Fe(s) +3CO2(g),20 min 后达到平衡,固体质量变为19.2 g,用CO2 表示的反应速率为________。
4Fe(s) +3CO2(g),20 min 后达到平衡,固体质量变为19.2 g,用CO2 表示的反应速率为________。
(4)炼铁过程中发生反应:2 Fe2O3(s) +3CO(g)![]() 2Fe(s) +3CO2(g)。
2Fe(s) +3CO2(g)。
①下图中能表示该反应的平衡常数对数值(1g K) 与温度的关系的是______(填“Ⅰ”或“Ⅱ”),原因是__________________。

②1500℃时,在某体积可变的密闭容器中按物质的量比2∶3加入Fe2O3 和CO,则达平衡时Fe2O3的转化率是________。
③下列说法能够提高Fe2O3 的转化率的是________(填字母)。
A.升高反应体系的温度 B.加人适量的Na2O 固体
C.对体系加压 D.增大CO 在原料中的物质的量比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行焰色反应检验钾离子时有以下步骤,其中正确的操作顺序是( )
①蘸取待测液 ②置于酒精灯火焰上灼烧 ③透过蓝色钴玻璃观察 ④用稀盐酸洗净铂丝
A.④②①②③B.①②③④C.④①②③D.②①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com