
【题目】化学用语是学习化学的重要工具,是国际通用的化学语言。
(1)请用化学用语填空:
①人体缺乏后会引起贫血的元素____________;②两个氢原子____________。;③三个二氧化硫分子_____________;④四个碳酸根离子____________。
(2)在符号“![]() O”中H正上方的“+1”表示____________,H右下角的“2”表示____________。
O”中H正上方的“+1”表示____________,H右下角的“2”表示____________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铜锈的主要成分是碱式碳酸铜。碱式碳酸铜受热分解的化学方程式为: Cu2(OH)2CO3![]() 2CuO+X+CO2↑。下列说法正确的是
2CuO+X+CO2↑。下列说法正确的是
A. 反应前后固体物质中铜元素的质量分数不变
B. 碱式碳酸铜中铜原子和氧原子的质量比为 8:5
C. X 是相对分子质量最小的氧化物
D. 加热 Cu2(OH)2CO3 的实验装置和实验室用双氧水制取 O2 的发生装置相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的属类归纳不正确的是( )
A. 由两种或两种以上元素组成的纯净物称为化合物
B. 由一种元素组成的纯净物是单质
C. 由一种物质组成的称为纯净物
D. 含氧元素的化合物称为氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是________(填编号)。
a.NH3比PH3稳定性强
b.常温下,氮气是气体,磷单质是固体
c.氮气与氢气化合比磷与氮气化合更容易
d.硝酸显强氧化性,磷酸不显强氧化性
(2)某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g)![]() 2ClNO(g) △H1< 0
2ClNO(g) △H1< 0
ii. 2NO2(g)+ NaCl(s)![]() NaNO3(s)+ClNO(g) △H2< 0
NaNO3(s)+ClNO(g) △H2< 0
现有反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ,则反应热△H3=_____(用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ,则反应热△H3=_____(用△H1、△H2表示)。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
2NH3(g) △H=-92.4kJ/mol。达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

① 曲线a 对应的温度是_______________。
② 上图中M、N、Q点平衡常数K的大小关系是_________。
③ M点对应的H2转化率是_____________。
(4)亚硝酸盐是食品添加剂中毒性较强的物质之一。在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO。写出Cu+和亚硝酸根(NO2-)离子在酸性水溶液中反应的离子方程式__________。
(5)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。用氨水SO2,当吸收液显中性时,溶液中离子浓度关系正确的是_______(填字母)。(已知:NH4HSO3溶液显酸性。)
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
c.c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):

已知:I. 
II. 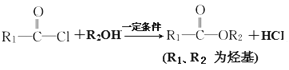
(1)G的名称________
(2)已知E能发生水解反应,则X的结构简式________
(3)C→D的反应类型是_______
(4)光刻胶的结构简式_______________________
(5)B→C第①步反应的化学方程式为_____________________
(6)H与C的分子式相同。满足下列条件的H的结构有_______种。
①分子结构中只有一个羟基,能与FeCl3溶液发生显色反应
②不能发生银镜反应
③分子中除苯环外无其它环状结构
(7)结合以上信息写出以A为原料制备丙三醇的合成路线流程图(其它试剂任选)。______________
合成路线流程图示例如下:CH3CHO![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波。可用于鞣制皮革、由矿石中提取银、除去自来水中的氯气等。实验室可用以下两种力法制备少量硫代酸钠晶体(Na2S2O3 5H2O)。
方法一:将SO2通入Na2CO3和Na2S的混合溶液中充分反应而得。其流程为:
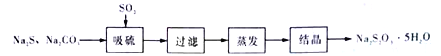
(1)SO2的制备
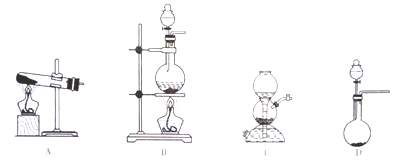
SO2的发生装置可以选择上图中的_______(填写选项的字母),反应的化学方程式为________________________________。
(2)吸硫装置如图所示。
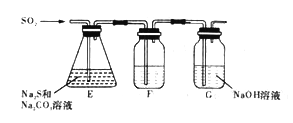
①装置F的作用是检验装置E中SO2的吸收效率,F中试剂是_____________。
②为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为_________。
③该过程须控制SO2的通入量,SO2通入量过少或过多均不利Na2S2O3 5H2O的制备。其原因是_________________________。
方法二:将硫粉与Na2SO3溶液混合共热。先取15.1 g Na2SO3溶于80.0 mL水中,再取5.00 g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。然后将上述溶液转移到仪器甲中,用小火加热至微沸.反应约为1 h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(3)仪器甲最好是_______(填写选项的字目)。
A.圆底烧瓶 B.蒸发皿 C.试管 D.烧杯
(4)若加入的硫粉不用乙醇润湿,对反应的影响是_____(填写选项的字目)。
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH值 D.会减少产量
(5)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,还可能存在一种杂质。如果滤液中该杂质的含量不很低,其检测的方法是:________________________。
(6)已知:2 Na2S2O3+I2==2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用碘水及操作均无不当,产生该结果最可能的原因是______________(写出一个原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( )

A. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 温度T下,该反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有色金属研究室对从银锰精矿中提取单质银的方法进行改良创新,从而更高效地实现锰和银的分离。其简易流程如下图。已知:银锰精矿主要成分为MnO2和银单质。
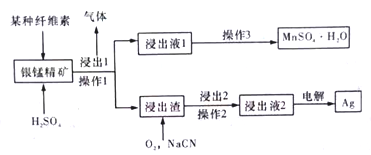

(1)操作1与操作2所对应的分离方法是__________________。
(2)通过对“浸出1”步骤中纤维细度的控制,绘制出一定时间内纤维素-Mn浸出率图象如上图所示,实际生产中应控制细度________mm较为合适,理由是_________。
(3)在“浸出1”步骤中,纤维素会先水解为单糖,请写出该单糖(用分子式表达)与银锰精矿反应的离子方程式:_______________________。
(4)浸出液2的主要成分为[Ag(CN)2]-,使用情性电极电解浸出液2,请写出阴极的电极方程式:________。本流程中可循环使用的物质为_________________。
(5)通过上述流程,浸出液1中通常还含有少量银离子,充分提取银,可对MnSO4·H2O晶体进行洗涤,请简述洗涤的方法_____________________________。将洗涤液与母液合并,加入盐酸,过滤后再经过以下步骤可回收大部分浸出液1中的银。试剂a是______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN废液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是_____________。
②浓度均为0.5 mol/L的NaCN和HCN的混合溶液显_________(填“酸”“碱”或“中”)性,通过计算说明:___________________________________。
(2)滤渣1的主要成分是______________(填化学式)。
(3)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_____________。
(4)系列操作B为_________________。
(5)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:_______________。
(6)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移向催化剂____________(填“a”或“b”)。
②催化剂a表面发生的反应为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com