
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波。可用于鞣制皮革、由矿石中提取银、除去自来水中的氯气等。实验室可用以下两种力法制备少量硫代酸钠晶体(Na2S2O3 5H2O)。
方法一:将SO2通入Na2CO3和Na2S的混合溶液中充分反应而得。其流程为:
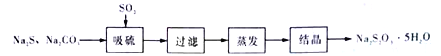
(1)SO2的制备
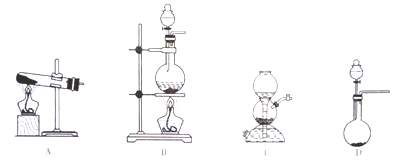
SO2的发生装置可以选择上图中的_______(填写选项的字母),反应的化学方程式为________________________________。
(2)吸硫装置如图所示。
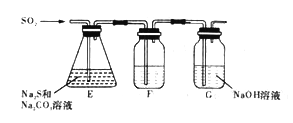
①装置F的作用是检验装置E中SO2的吸收效率,F中试剂是_____________。
②为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为_________。
③该过程须控制SO2的通入量,SO2通入量过少或过多均不利Na2S2O3 5H2O的制备。其原因是_________________________。
方法二:将硫粉与Na2SO3溶液混合共热。先取15.1 g Na2SO3溶于80.0 mL水中,再取5.00 g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。然后将上述溶液转移到仪器甲中,用小火加热至微沸.反应约为1 h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(3)仪器甲最好是_______(填写选项的字目)。
A.圆底烧瓶 B.蒸发皿 C.试管 D.烧杯
(4)若加入的硫粉不用乙醇润湿,对反应的影响是_____(填写选项的字目)。
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH值 D.会减少产量
(5)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,还可能存在一种杂质。如果滤液中该杂质的含量不很低,其检测的方法是:________________________。
(6)已知:2 Na2S2O3+I2==2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用碘水及操作均无不当,产生该结果最可能的原因是______________(写出一个原因即可)。
【答案】 B Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O [或D(1分)Na2SO3+H2SO4(浓)== Na2SO4+ SO2↑+H2O (1分)](其他合理答案也行) 品红溶液(或溴水或酸性KMnO4,溶液或KHSO3溶液等) 2 :1 SO2通入量过少原料利用率低且产品中杂质较多,SO2通入量过多溶液酸性增强导致产品分解 A AD 取出少许溶液,加稀盐酸至酸性后,过滤除去S后取滤液(或静置澄清、离心分离取澄清液),再加入BaCl2溶液,观察是否有白色沉淀产生,若出现白色沉淀,则含有Na2SO4,反之不含 晶体中含有Na2SO3等还原性杂质(或所得晶休中结晶水数目少于5等)
CuSO4+SO2↑+2H2O [或D(1分)Na2SO3+H2SO4(浓)== Na2SO4+ SO2↑+H2O (1分)](其他合理答案也行) 品红溶液(或溴水或酸性KMnO4,溶液或KHSO3溶液等) 2 :1 SO2通入量过少原料利用率低且产品中杂质较多,SO2通入量过多溶液酸性增强导致产品分解 A AD 取出少许溶液,加稀盐酸至酸性后,过滤除去S后取滤液(或静置澄清、离心分离取澄清液),再加入BaCl2溶液,观察是否有白色沉淀产生,若出现白色沉淀,则含有Na2SO4,反之不含 晶体中含有Na2SO3等还原性杂质(或所得晶休中结晶水数目少于5等)
【解析】(1)实验室利用浓硫酸和Na2SO3固体混合制SO2,反应不需要加热且Na2SO3固体易溶于水,则可选择上图中D装置进行制备,反应的化学方程式为Na2SO3+H2SO4(浓)= Na2SO4+ SO2↑+H2O;
(2)①SO2能使品红或酸性高锰酸钾溶液褪色,则F中试剂可选择品红或酸性高锰酸钾溶液;
②在Na2S和Na2CO3的混合液中通入SO2,发生反应化学方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,则保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为2:1;
③ 因SO2通入量过少原料利用率低且产品中杂质较多,SO2通入量过多溶液酸性增强导致产品分解,则该过程须控制SO2的通入量;
(3)乙醇易挥发且易燃烧,为防止乙醇污染,可选择圆底烧瓶通过蒸馏操作除去乙醇,故仪器甲最好选用圆底烧瓶,答案为A。
(4)用乙醇对硫粉湿润,便于硫能被水浸润,题干反应接触面积,增大反应速率,提高反应物利用率,若加入的硫粉不用乙醇润湿会降低反应速率,减少产物的产率;A.硫粉不用乙醇润湿会降低反应速率,故A正确;B.反应条件是用小火加热至微沸,硫粉不用乙醇湿润不需要提高反应温度,故B错误;C.硫粉不用乙醇湿润,对溶液pH无影响,所以不改变反应体系的pH值,故C错误;D.硫粉反应少得到产物,会减少产量,故D正确;故答案为AD;
(5)加热过程中亚硫酸钠易被氧化为硫酸钠,检测方法是:取出少许溶液,加稀盐酸至酸性后,过滤除去S后取滤液(或静置澄清、离心分离取澄清液),再加入BaCl2溶液,观察是否有白色沉淀产生,若出现白色沉淀,则含有Na2SO4,反之不含;
(6)碘单质有强的氧化性,Na2SO3具有还原性,Na2SO3会和I2发生反应,从而影响纯度。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】某黑色固体粉末可能是 Fe、FeO、CuO、C 中一种或几种。为了探究其成分,小明同学按照下 图所示流程进行了实验。
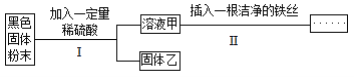
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定含有 Fe;
②若步骤Ⅱ中无明显现象,则固体乙中最多只能 有四种物质;
③若步骤Ⅱ中 有气泡产生,则原固体可能是纯净物也可能是混合物;
④若步骤Ⅱ中有红色固体析出,则固体乙中一定无 CuO;
⑤固 体乙呈红色,则原固体中一定含有 Fe 和 CuO。 以上说法中正确的个数是
A. 1 个 B. 2 个 C. 3 个 D. 4 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种措施,其中能减少酸雨产生的措施是( )
①对燃烧煤时产生的尾气进行除硫处理 ②少用原煤作燃料 ③燃煤时鼓入足量空气 ④开发清洁能源
A. ①②③ B. ②③④
C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算;
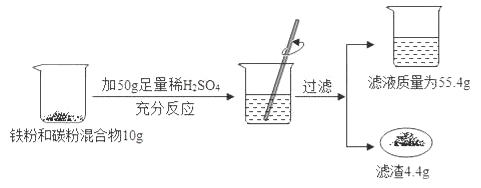
(1)混合物中铁的质量_________________________;
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数_________________;
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水多少克?__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,是国际通用的化学语言。
(1)请用化学用语填空:
①人体缺乏后会引起贫血的元素____________;②两个氢原子____________。;③三个二氧化硫分子_____________;④四个碳酸根离子____________。
(2)在符号“![]() O”中H正上方的“+1”表示____________,H右下角的“2”表示____________。
O”中H正上方的“+1”表示____________,H右下角的“2”表示____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备过碳酸钠(2Na2CO3·3H2O2)的一种流程如下:
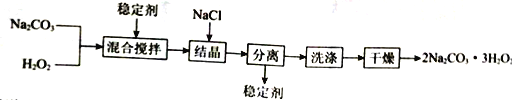
下列说法不正确的是
A. 可以用MnO2作稳定剂
B. “结晶”时,加入NaCl的主要作用是增大产品的产率
C. “分离”所用的主要玻璃仪器为烧杯、漏斗、玻璃棒
D. 2Na2CO3·3H2O2受热分解属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,将1L混合烃与9L氧气混合没在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是
A. 甲烷与乙烷的体积比是1∶4 B. 丙炔与乙炔的体积比是1∶4
C. 乙烯与丁烷的体积比是1∶4 D. 乙烯与丁烯的体积比是1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com