
【题目】某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算;
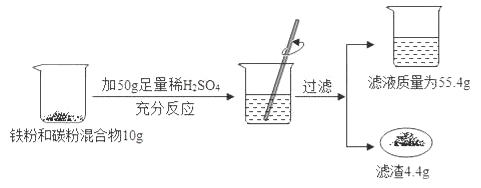
(1)混合物中铁的质量_________________________;
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数_________________;
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水多少克?__________。
【答案】 5.6g 19.6% 160克。
【解析】铁粉与碳粉混合物中加入足量的稀盐酸,铁能与稀盐酸反应,碳不能与盐酸反应,根据质量守恒定律减少的质量是生成的氢气的质量,根据氢气的质量可求出硫酸中溶质的质量,再根据溶质的质量分数的计算公式进行有关的计算,则
(1)混合物中铁的质量是:10g-4.4g=5.6g;
(2)生成氢气的质量为:50g+10g-55.4g-4.4g=0.2g,设稀硫酸中溶质的质量为x,则
Fe+H2SO4=FeSO4+H2↑
98 2
x 0.2g
98/2=x/0.2g
解得:x=9.8g
所用稀硫酸溶液中溶质的质量分数是:9.8g/50g×100%=19.6%;
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,设需要水的质量为y,则(200g-y)×98%=200g×19.6% 解得:y=160g。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】下列关于煤、石油、天然气的说法正确的是
A. 丙烯等石油产品可用于生产塑料
B. 水煤气是通过煤的干馏得到的气体燃料
C. 天然气只能用做燃料
D. 石油裂化得到的汽油是一种纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.0100mol/L的KMnO4标准溶液滴定某未知浓度的H2C2O4溶液,下列说法错误的是
A. 该滴定实验不需要指示剂
B. 该实验用到的玻璃仪器有酸式滴定管、碱式滴定管、锥形瓶
C. 滴定管使用前需检验是否漏液
D. 若滴定终止时,仰视读数,所测H2C2O4浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的说法和理解正确的是( )
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C. 国际上规定,0.012 kg碳原子所含有的碳原子数目为1 mol
D. 摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是________(填编号)。
a.NH3比PH3稳定性强
b.常温下,氮气是气体,磷单质是固体
c.氮气与氢气化合比磷与氮气化合更容易
d.硝酸显强氧化性,磷酸不显强氧化性
(2)某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g)![]() 2ClNO(g) △H1< 0
2ClNO(g) △H1< 0
ii. 2NO2(g)+ NaCl(s)![]() NaNO3(s)+ClNO(g) △H2< 0
NaNO3(s)+ClNO(g) △H2< 0
现有反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ,则反应热△H3=_____(用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ,则反应热△H3=_____(用△H1、△H2表示)。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
2NH3(g) △H=-92.4kJ/mol。达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

① 曲线a 对应的温度是_______________。
② 上图中M、N、Q点平衡常数K的大小关系是_________。
③ M点对应的H2转化率是_____________。
(4)亚硝酸盐是食品添加剂中毒性较强的物质之一。在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO。写出Cu+和亚硝酸根(NO2-)离子在酸性水溶液中反应的离子方程式__________。
(5)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。用氨水SO2,当吸收液显中性时,溶液中离子浓度关系正确的是_______(填字母)。(已知:NH4HSO3溶液显酸性。)
a.c(NH4+)=2c(SO32-)+c(HSO3-)
b.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
c.c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波。可用于鞣制皮革、由矿石中提取银、除去自来水中的氯气等。实验室可用以下两种力法制备少量硫代酸钠晶体(Na2S2O3 5H2O)。
方法一:将SO2通入Na2CO3和Na2S的混合溶液中充分反应而得。其流程为:
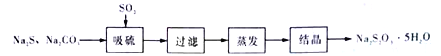
(1)SO2的制备
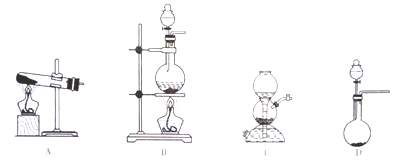
SO2的发生装置可以选择上图中的_______(填写选项的字母),反应的化学方程式为________________________________。
(2)吸硫装置如图所示。
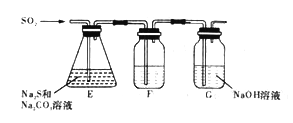
①装置F的作用是检验装置E中SO2的吸收效率,F中试剂是_____________。
②为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为_________。
③该过程须控制SO2的通入量,SO2通入量过少或过多均不利Na2S2O3 5H2O的制备。其原因是_________________________。
方法二:将硫粉与Na2SO3溶液混合共热。先取15.1 g Na2SO3溶于80.0 mL水中,再取5.00 g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。然后将上述溶液转移到仪器甲中,用小火加热至微沸.反应约为1 h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(3)仪器甲最好是_______(填写选项的字目)。
A.圆底烧瓶 B.蒸发皿 C.试管 D.烧杯
(4)若加入的硫粉不用乙醇润湿,对反应的影响是_____(填写选项的字目)。
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH值 D.会减少产量
(5)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,还可能存在一种杂质。如果滤液中该杂质的含量不很低,其检测的方法是:________________________。
(6)已知:2 Na2S2O3+I2==2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用碘水及操作均无不当,产生该结果最可能的原因是______________(写出一个原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和乙烷的混合气体共a mol,与b mol O2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g H2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)= 。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的![]() 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
(3)a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
a(g)+ b(g)![]() 2c(g)△H1<0
2c(g)△H1<0
x(g)+ 3y(g)![]() 2z(g)△H2 >0
2z(g)△H2 >0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com