
【题目】乙烯和乙烷的混合气体共a mol,与b mol O2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g H2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)= 。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的![]() 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
(3)a的取值范围是 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】煤是重要的能源,也是生产化工产品的重要原料。随着人类社会的飞速发展,化石能 源大量消耗,人类已经面临较严重的能源危机。为此,提高能源的利用率和开发更多的新能源 显得相当重要。下图是煤化工产业链的一部分。
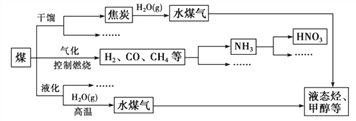
请回答:
(1)任意列举两项新能源_____。
(2)上述处理煤的过程属于_____(填“物理”或“化学”)变化。
(3)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是 将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达 60%)成分的水溶液里,其中一种反应的化学方程式是:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则 X 的名称是_____。
(4)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
![]()
这种脱硫技术称为微生物脱硫技术。该技术的两步反应的化学方程式依次是_____________ 。
(5)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨—空 气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到 100%,理论上 γ[n(O2)/n(NH3)]=1.25,实际 生产要将 γ 值维护在 1.7~2.2 之间, 原因是___________。 [温馨提示:n(O2)是可以认为是表示氧气分子堆积数目的一种物理量,即 n(O2)值越大,说明氧分子数目 越多]
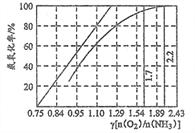
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算;
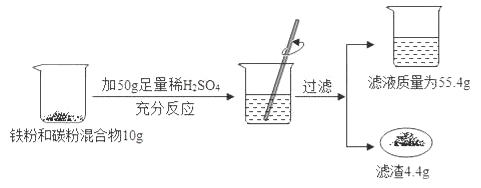
(1)混合物中铁的质量_________________________;
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数_________________;
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水多少克?__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备过碳酸钠(2Na2CO3·3H2O2)的一种流程如下:
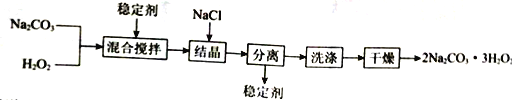
下列说法不正确的是
A. 可以用MnO2作稳定剂
B. “结晶”时,加入NaCl的主要作用是增大产品的产率
C. “分离”所用的主要玻璃仪器为烧杯、漏斗、玻璃棒
D. 2Na2CO3·3H2O2受热分解属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,将1L混合烃与9L氧气混合没在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是
A. 甲烷与乙烷的体积比是1∶4 B. 丙炔与乙炔的体积比是1∶4
C. 乙烯与丁烷的体积比是1∶4 D. 乙烯与丁烯的体积比是1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3。[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式是________________。
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是__________、__________。
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x =_______。
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3的VSEPR模型名称为_____;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com