
【题目】下列物质在一定条件下,可以与甲烷发生反应的是( )
A. 浓硫酸 B. 溴水
C. 氧气 D. 酸性高锰酸钾溶液
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波。可用于鞣制皮革、由矿石中提取银、除去自来水中的氯气等。实验室可用以下两种力法制备少量硫代酸钠晶体(Na2S2O3 5H2O)。
方法一:将SO2通入Na2CO3和Na2S的混合溶液中充分反应而得。其流程为:
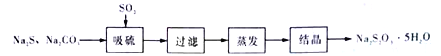
(1)SO2的制备
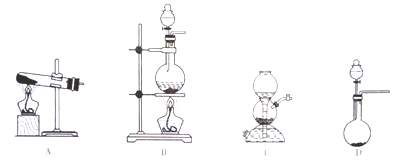
SO2的发生装置可以选择上图中的_______(填写选项的字母),反应的化学方程式为________________________________。
(2)吸硫装置如图所示。
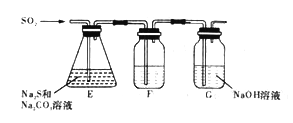
①装置F的作用是检验装置E中SO2的吸收效率,F中试剂是_____________。
②为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为_________。
③该过程须控制SO2的通入量,SO2通入量过少或过多均不利Na2S2O3 5H2O的制备。其原因是_________________________。
方法二:将硫粉与Na2SO3溶液混合共热。先取15.1 g Na2SO3溶于80.0 mL水中,再取5.00 g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。然后将上述溶液转移到仪器甲中,用小火加热至微沸.反应约为1 h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(3)仪器甲最好是_______(填写选项的字目)。
A.圆底烧瓶 B.蒸发皿 C.试管 D.烧杯
(4)若加入的硫粉不用乙醇润湿,对反应的影响是_____(填写选项的字目)。
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH值 D.会减少产量
(5)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,还可能存在一种杂质。如果滤液中该杂质的含量不很低,其检测的方法是:________________________。
(6)已知:2 Na2S2O3+I2==2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用碘水及操作均无不当,产生该结果最可能的原因是______________(写出一个原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/cm3。
(1)此浓盐酸的物质的量浓度是多少?(列式计算)_________________
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?(列式计算)_____________
(3)用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号)_________________
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
a(g)+ b(g)![]() 2c(g)△H1<0
2c(g)△H1<0
x(g)+ 3y(g)![]() 2z(g)△H2 >0
2z(g)△H2 >0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN废液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是_____________。
②浓度均为0.5 mol/L的NaCN和HCN的混合溶液显_________(填“酸”“碱”或“中”)性,通过计算说明:___________________________________。
(2)滤渣1的主要成分是______________(填化学式)。
(3)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_____________。
(4)系列操作B为_________________。
(5)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:_______________。
(6)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移向催化剂____________(填“a”或“b”)。
②催化剂a表面发生的反应为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第________周期第________族。W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子价层电子排布式为________________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗数的数值,下列说法中正确的是
A.1L1mol/L的K2Cr2O7溶液中
B.1molC60F60分子中碳原子之间共用电子对数为90 NA
C.电解精炼铜时,若阴极得到电子数为2 NA个,则阳极质量减少64g
D.标准状况下,2.24LCl2完全溶于水转移电子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL1的盐酸,测得溶液中的CO32、HCO3、AlO2、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1 = 4.3×107,K2 = 5.6×1011;Al(OH)3的酸式电离平衡常数K=6.3×1013)

A. a曲线表示的离子方程式为:AlO2+4H+ = Al3+ + 2H2O
B. M点时生成的CO2为0.05 mol
C. 原混合溶液中的CO32与AlO2的物质的量之比为1:2
D. V1:V2=1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液稀释相同倍数后,溶液的pH:① ②,③ ④,⑤ ⑥(选填“>”、“<”或“=”);
⑷将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈 (填序号)
A.酸性 B.碱性 C.中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com