
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液稀释相同倍数后,溶液的pH:① ②,③ ④,⑤ ⑥(选填“>”、“<”或“=”);
⑷将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈 (填序号)
A.酸性 B.碱性 C.中性
【答案】⑴⑥ ②③④ ⑵ > ⑶ > > >⑷ ABC
【解析】(1)水属于弱电解质,存在电离平衡H2O![]() H++OH-,根据电离出的离子可知酸或碱是抑制水的电离,而盐类的水解则是促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在①②③④⑤中均是抑制水的电离的。因为②③④中H+浓度或OH-的浓度均是0.01mol,所以对水的电离抑制程度是相同的。
H++OH-,根据电离出的离子可知酸或碱是抑制水的电离,而盐类的水解则是促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在①②③④⑤中均是抑制水的电离的。因为②③④中H+浓度或OH-的浓度均是0.01mol,所以对水的电离抑制程度是相同的。
(2)。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以②③等体积混合后氨水过量,溶液显碱性,要使溶液显中性,盐酸的体积必须大于氨水的体积。
(3)弱电解质在稀释过程中是促进电离的,即离子的物质的量是增加的。而强电解质在溶液中不存在电离平衡,因此稀释时离子的物质的量是不变的。①②稀释相同倍数后二者的浓度仍然相等,所以pH前者大。③④稀释前pH相等,但稀释后③中OH-的物质的量要大于④中的,所以pH是前者大。稀释前⑤显碱性,⑥显中性,所以稀释后仍然是前者的pH大。
(4)①④混合后,根据电荷守恒可知c(H+)+c(Na+)=c(OH-)+c(CH3COO-),若c(CH3COO-)>c(H+),则c(Na+)>c(OH-)。但c(H+和c(OH-)的大小关系无法确定,所以该溶液可能显酸性、碱性或中性。


科目:高中化学 来源: 题型:
【题目】能将氯化铁、氯化铵和氯化钠三种溶液区别开的一种试剂是 ( )
A. KSCN溶液 B. BaCl2溶液
C. AgNO3溶液 D. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下、相同体积的任何气体都含有相同数目和分子”,他们设计了如下实验装置并记录相关实验数据。
实验装置:
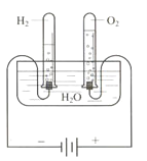
部分实验数据:
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2物质的量分别是 mol、 mol。
(2)该温度下,气体摩尔体积是 。
(3)假设电解H2O速率相同,2分钟时试管内收集到的H2的体积是 mL。
(4)根据以上实验得出如下结论,其中不正确的是 。
A. 气体摩尔体积与气体的温度相关
B. 在该实验条件下,3 mol O2的气体摩尔体积为74.58 L/mol
C. 同温、同压下,2 mol O2和2 mol CO和CO2混合气体的体积相同
D. 该实验条件下,O2的密度为1.287 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质中,属于烷烃特征的是( )
A.完全燃烧产物只有二氧化碳和水
B.它们几乎不溶于水
C.分子的通式为CnH2n+2,与氯气发生取代反应
D.它们是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物都是形成雾霾天气的重要因素。下列方法可处理氮氧化物和硫氧化物。
(1) 用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,在一定条件下,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ/mol。
N2(g)+CO2(g) ΔH=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 |
NO | 1.00 | 0.58 | 0.40 | 0.40 |
N2 | 0 | 0.21 | 0.30 | 0.30 |
CO2 | 0 | 0.21 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)=_____________,T1℃时,该反应的平衡常数K= _____________。
②若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2∶1∶1,则Q_____________ (填“>”、“=”或“<”) 0。
(2) NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。

①由图甲可知,SCR技术中的氧化剂为_____________。已知 NH3氧化时发生如下反应:
4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH2=-1811.63kJ·mol-1
则氨气被氧化为氮气和水蒸气的热化学方程式:_______________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂及相应的温度分别为___________、___________。
(3) 烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,若所得溶液呈中性,则该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
(4) 某研究小组用NaOH溶液吸收二氧化硫后,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图丙所示,电极材料为石墨。

丙
①a表示_______(填“阴”或“阳”)膜。A-E分别代表原料或产品,其中C为稀硫酸,则A为____________溶液(填写化学式)。
②阳极电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应条件(如温度、浓度或物质的量等)发生改变时,下列不会引起生成物发生改变的是
A. 钠和氧气 B. 锌和硫酸 C. 氢氧化钠和二氧化碳 D. 氢气和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列说法正确的是
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应开始到10s,Y的转化率为79.0%
C. 反应开始到10s,X的物质的量浓度减少了0.79mol/L
D. 反应的化学方程式:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CuCl2溶液与乙二胺H2N-CH2CH2-NH2[常用(en)表示]作用,可形成配离子(如图所示):

请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是____________,
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是___________________________。
②上述配离子中含有的化学键类型有:__________________。(填写代码,多选) ;
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为_______;其中铜离子的配位数是_______。
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为__________________
②Fe元素位于周期表的_____区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____;
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______和______(填化学式)。
③根据VSEPR理论预测ED4-离子的空间构型为_________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为____________(写2种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com