
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第________周期第________族。W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子价层电子排布式为________________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
________________________________________________________________________。
【答案】 二 ⅤA 弱 3s23p4 大 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】导致酸雨的主要物质是二氧化氮和二氧化硫,且W、X、Y、Z是周期表前36号元素中的四种常见元素,Y的原子序数大于W的,所以W是氮元素,Y是硫元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W小于Y,所以X是铝元素;Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,且Z是前36号元素,Z的原子序数大于Y的,所以Z是铜元素。
(1)W是N元素,N原子的原子结构示意图为![]() ,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;气态氢化物的稳定性与元素的非金属性有关系,非金属越强,气态氢化物的稳定性越强,氧元素的非金属性大于氮元素的非金属性,所以水的稳定性大于氨气的稳定性;(2)Y为硫元素,硫原子核外电子数为16,基态核外电子排布式为1s22s22p63s23p4,硫为非金属,X为铝元素,非金属的第一电离能高于金属的第一电离能,故Y的第一电离能比X的大;(3)浓硫酸和铜在加热条件下能反应生成硫酸铜、水和二氧化硫,方程式为:Cu+2H2SO4(浓)
,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;气态氢化物的稳定性与元素的非金属性有关系,非金属越强,气态氢化物的稳定性越强,氧元素的非金属性大于氮元素的非金属性,所以水的稳定性大于氨气的稳定性;(2)Y为硫元素,硫原子核外电子数为16,基态核外电子排布式为1s22s22p63s23p4,硫为非金属,X为铝元素,非金属的第一电离能高于金属的第一电离能,故Y的第一电离能比X的大;(3)浓硫酸和铜在加热条件下能反应生成硫酸铜、水和二氧化硫,方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】工业上制备过碳酸钠(2Na2CO3·3H2O2)的一种流程如下:
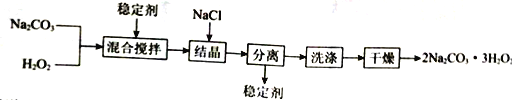
下列说法不正确的是
A. 可以用MnO2作稳定剂
B. “结晶”时,加入NaCl的主要作用是增大产品的产率
C. “分离”所用的主要玻璃仪器为烧杯、漏斗、玻璃棒
D. 2Na2CO3·3H2O2受热分解属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3。[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式是________________。
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是__________、__________。
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x =_______。
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3的VSEPR模型名称为_____;在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列放热反应的说法中正确的是( )
A. 只要是释放热量的变化就是放热反应
B. 只要是释放热量的化学变化就是放热反应
C. 不需要加热就能反应的化学反应就是放热反应
D. 反应物的总能量小于生成物的总能量的化学反应就是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:

已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为___________。
(2)根据实验目的,选择合适的实验步骤:①→____________。
①组装好装置,_________________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加人冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_________________。
(4)反应完毕后,U形管内的现象是_________;分离溴乙烷时所需的玻璃仪器是___________。
(5)假设最初取用的无水乙醇是71.9 mL,最后得到的纯净的溴乙烷是66.2 mL,则溴乙烷的产率为______________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH(CH2CH3)3的名称是3-甲基戊烷
B. ![]() 和
和![]() 、
、![]() 和
和![]() 都属于同一种物质
都属于同一种物质
C. 乙醛和丙烯醛(![]() )不是同系物,与氢气充分反应后产物也不是同系物
)不是同系物,与氢气充分反应后产物也不是同系物
D. 向苯中加入酸性高锰酸钾溶液震荡后静置,观察到液体分层,且上、下层均无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物都是形成雾霾天气的重要因素。下列方法可处理氮氧化物和硫氧化物。
(1) 用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,在一定条件下,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ/mol。
N2(g)+CO2(g) ΔH=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 |
NO | 1.00 | 0.58 | 0.40 | 0.40 |
N2 | 0 | 0.21 | 0.30 | 0.30 |
CO2 | 0 | 0.21 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)=_____________,T1℃时,该反应的平衡常数K= _____________。
②若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2∶1∶1,则Q_____________ (填“>”、“=”或“<”) 0。
(2) NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。

①由图甲可知,SCR技术中的氧化剂为_____________。已知 NH3氧化时发生如下反应:
4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH2=-1811.63kJ·mol-1
则氨气被氧化为氮气和水蒸气的热化学方程式:_______________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂及相应的温度分别为___________、___________。
(3) 烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,若所得溶液呈中性,则该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
(4) 某研究小组用NaOH溶液吸收二氧化硫后,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图丙所示,电极材料为石墨。

丙
①a表示_______(填“阴”或“阳”)膜。A-E分别代表原料或产品,其中C为稀硫酸,则A为____________溶液(填写化学式)。
②阳极电极反应式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com