
【题目】下列放热反应的说法中正确的是( )
A. 只要是释放热量的变化就是放热反应
B. 只要是释放热量的化学变化就是放热反应
C. 不需要加热就能反应的化学反应就是放热反应
D. 反应物的总能量小于生成物的总能量的化学反应就是放热反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下反应N2O4(g)![]() 2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是
2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是
①加压时(体积变小),将使正反应速率增大②保持体积不变,加入少许NO2,将使正反应速率减小;③保持体积不变,加入少许N2O4,再达到平衡时颜色变深;④保持体积不变,升高温度,再达平衡时颜色变深 ⑤升高温度,正反应速率减小,平衡逆向移动
A. ①④⑤ B. ③④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
a(g)+ b(g)![]() 2c(g)△H1<0
2c(g)△H1<0
x(g)+ 3y(g)![]() 2z(g)△H2 >0
2z(g)△H2 >0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
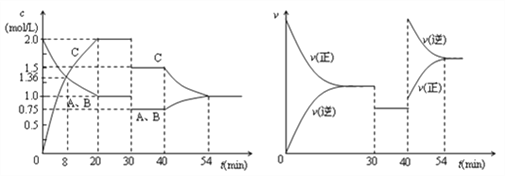
A. 前20min B的平均反应速率为0.05mol·L-1·min-1
B. 8 min时表示正反应速率等于逆反应速率
C. 反应方程式中的x=1,30 min时表示增大压强
D. 40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第________周期第________族。W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子价层电子排布式为________________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4.8 g O2和0.2 mol CO2,质量之比是 ,在同温同压下的体积之比是 。相同物质的量的SO2和SO3,所含分子的数目之比为 ,所含O原子的物质的量之比为 。
(2)在标准状况下,将224 L HCl气体溶于635 mL水(ρ=1.0 g·cm3)中,所得盐酸的密度为1.18 g·cm3。试计算:
①所得盐酸的物质的量浓度为 。
②取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度为 。
③现用0.1 mol·L1的NaOH溶液中和②中盐酸100 mL,需要NaOH溶液体积为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com