
| 实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
分析 (1)根据实验具体操作步骤有:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等,来选择实验所需仪器;
(2)根据c(酸)=$\frac{c碱×V碱}{V酸}$,判断不当操作对相关物理量的影响;
(3)根据c(酸)=$\frac{c碱×V碱}{V酸}$计算.
解答 解:(1)一定规格的容量瓶只能配制相应体积的溶液,容量瓶应选择250ml规格;一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、胶头滴管,
故答案为:烧杯、玻璃棒、250ml容量瓶、胶头滴管;
(2)对比表中数据,误差较大的是第1次实验,需要标准液的体积偏大,由c(酸)×V(酸)=c(碱)×V(碱)判断:
a.在装未知浓度盐酸前锥形瓶里面有少量水,未烘干,无影响,故错误;
b.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次,标准液浓度偏小,则体积偏大,故正确;
c.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡,会导致读数偏大,故正确;
d.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡,会导致体积偏小,故错误;
e.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来,导致需要标准液体积偏小,故错误;
f.达到滴定终点时,俯视溶液凹液面最低点读数,会导致读数偏小,故错误;
g.滴定到终点时,溶液颜色由无色变到了红色,导致需要标准液体积偏大,故正确;
故答案为:1;bcg;
(3)取2、3体积进行计算,所用标准液的平均体积为$\frac{17.10+16.90}{2}$mL=17.0mL,
则根据c(酸)=$\frac{c碱×V碱}{V酸}$=$\frac{0.5mol/L×17}{20}$=0.425mol/L,
故答案为:0.425mol/L.
点评 本题考查了中和滴定及误差分析,要求选择掌握中和滴定的操作方法及完成分析的方法,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


科目:高中化学 来源: 题型:解答题
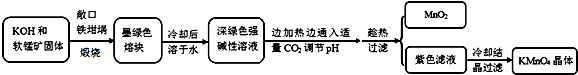
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
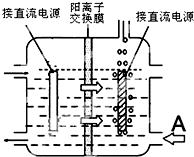
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
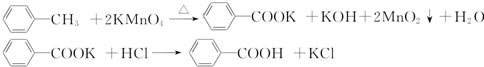
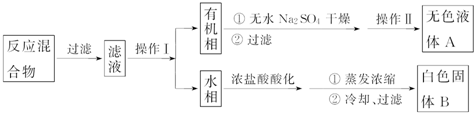
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入稀HNO3酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
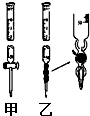 Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
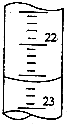 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com