
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
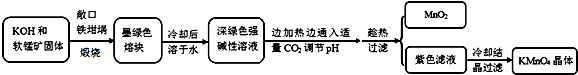
分析 以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体,软锰矿固体和KOH固体混合在铁坩埚中煅烧,得到墨绿色熔块,为锰酸钾,冷却后溶于水其水溶液呈深绿色,这是锰酸根(MnO42-)在碱溶液中的特征颜色,边加热边通入适量二氧化碳气体,调节溶液PH趁热过滤得到二氧化锰固体和高锰酸钾溶液,冷却结晶得到高锰酸钾晶体,
(1)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;
(2)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4;氧化还原反应中氧化剂是元素化合价降低的物质,还原剂是元素化合价升高的物质,结合化学方程式定量关系和电子守恒计算;
(3)分析盐酸具有还原性容易被高锰酸钾氧化,使产品变质,硫酸反应生成的硫酸钾溶解度小,会随高锰酸钾晶体析出;
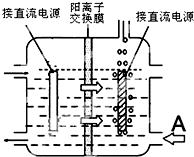
(4)惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中氢离子在阴极得到电子生成氢气,溶液中氢氧根离子浓度增大生成碱,阳离子交换膜分隔两极区进行电解锰酸钾溶液制取高锰酸钾,阳离子移向方向可知左边电极为阳极,右边冒气泡的电极为阴极,为维持电解质溶液电荷守恒,A处最好加入氢氧化钾溶液,使用阳离子交换膜可以提高Mn元素利用率是因为阳离子交换膜防止锰酸根进入阴极区.
解答 解:(1)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀,加热软锰矿和KOH固体时,不采用瓷坩埚而选用铁坩埚,
故答案为:高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;
(2)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,实验中通入适量CO2时体系中可能发生反应离子方程式为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O,其中氧化还原反应中氧化剂和还原剂都是高锰酸钾,所以氧化剂和还原剂的质量比即为反应的物质的量之比为1:2,
故答案为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;1:2;
(3)因为盐酸具有还原性,易被高锰酸钾氧化,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时基本上都会留在母液中,硫酸加入生成的硫酸钾溶解度小,会随KMnO4一起结晶析出得到的高锰酸钾中含有杂质,
故答案为:A;
(4)惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中氢离子在阴极得到电子生成氢气,溶液中氢氧根离子浓度增大生成碱,电解反应的化学方程式为:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH,阳离子交换膜分隔两极区进行电解锰酸钾溶液制取高锰酸钾,阳离子移向方向可知左边电极为阳极,右边冒气泡的电极为阴极,为维持电解质溶液电荷守恒,A处最好加入氢氧化钾溶液,使用阳离子交换膜可以提高Mn元素利用率是因为阳离子交换膜防止锰酸根进入阴极区被还原,
故答案为:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
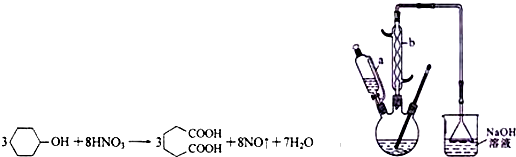
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
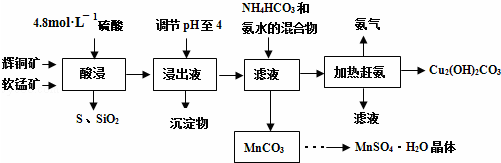
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
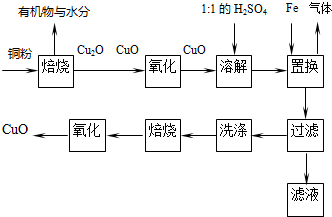
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com