
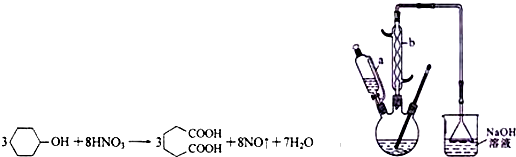
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
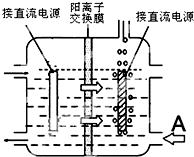
分析 (1)仪器b为球形冷凝管;采取逆流原理通入冷凝水,使冷凝管中充满冷凝水,使挥发的有机物进行冷凝回流,提高原料利用率;平衡滴液漏斗与圆底烧瓶内压强,便于液体顺利流下;
(2)根据c=$\frac{1000ρw}{M}$计算该硝酸的物质的量浓度; 氢氧化钠溶液吸收NO2,防止污染空气;
(3)将三颈烧瓶置于冰水浴中冷却;
(4)己二酸不溶于苯,而环己醇易溶于苯,要减小因洗涤导致的损失,可以用苯洗涤.
解答 解:(1)装置图中仪器b为球形冷凝管(或冷凝管),采取逆流原理通入冷凝水,使冷凝管中充满冷凝水,使挥发的有机物进行冷凝回流,提高原料利用率,即从冷凝管的下口通入,从上口流出,滴液漏斗的细支管a的作用是:平衡滴液漏斗与圆底烧瓶内压强,便于环己醇顺利流下,
故答案为:球形冷凝管;下口;平衡滴液漏斗与圆底烧瓶内压强,便于环己醇顺利流下;
(2)根据c=$\frac{1000ρw}{M}$,可知50%的硝酸(密度为1.31g/cm3)的物质的量浓度为$\frac{1000×1.31×50%}{63}$mol/L=10.4mol/L,NaOH溶液的作用是吸收二氧化氮气体防止污染空气,
故答案为:10.4mol/L;吸收NO2,防止污染空气;
(3)为使反应温度不致过高,必要时可采取的措施是:将三颈烧瓶置于冰水浴中冷却,
故答案为:将三颈烧瓶置于冰水浴中;
(4)溶解度随温度变化较大,向用冰水洗涤,有利于结晶析出,由于己二酸不溶于苯,而环己醇易溶于苯,要减小因洗涤导致的损失,可以用苯洗涤,
故答案为:冷水;苯.
点评 本题考查有机物的制备实验,涉及对反应原理的分析、仪器的识别、物质分离提纯、对操作与装置的分析评价等,侧重考查学生对信息的获取与迁移应用,难度中等.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 | |
| B. | Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和离子浓度无关 | |
| C. | 在一定温度下的BaSO4饱和溶液中加入少量BaCl2固体,BaSO4的Ksp减少 | |
| D. | 当阴、阳离子个数比相同时,难溶电解质的Ksp数值越大,溶解能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | KOH溶液的 浓度/mol•L-1 | 滴定完成时,KOH溶液滴入的体积/mL | 待测盐的体积/mL酸 |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
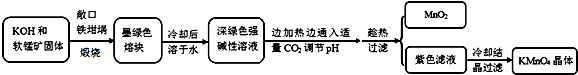
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
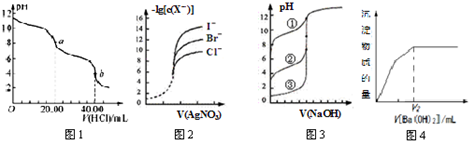
| A. | 图1是用0.l000 mol•L-1的盐酸滴定20.00 mL 0.l000mol•L-1Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+=CO2↑+H2O | |
| B. | 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | |
| C. | 用0.1000 mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图3曲线确定①的酸性最强 | |
| D. | 图Ⅳ表示明矾中滴入Ba(OH)2溶液,图中的V2表示生成的氢氧化铝恰好溶解时加入Ba(OH)2溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com