
(12分)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,
H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
A.配位键 B.极性键 C.离子键 D.非极性键
E.氢键 F.金属键
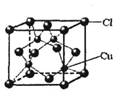
(5)CuCl的晶胞结构如右图所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为 。
(1)3d9(1分); O>N>H(1分) (2)V型(1分);
(3)sp3杂化(1分);乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键(2分)
(4)4(2分); ABD(2分) (5)4(2分)
【解析】(1)根据构造原理可知,铜离子的基态外围电子排布式为3d9。非金属性越强,电负性越大,即电负性大小顺序是 O>N>H。
(2)根据价层电子对互斥理论可知,SO2中S原子含有的孤对电子对数是(6-2×2)÷2=1,所以SO2是V型结构。
(3)乙二胺分子中氮原子形成的全部是单键,因此是sp3杂化。由于乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以前者的沸点高于后者。
(4)根据结构式可知,配离子[Cu(En)2]2+的配位数为4,含有的作用力是ABD。
(5)根据晶胞结构可知,与Cl-最近距离的Cu+的个数是4个,恰好构成正四面体。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
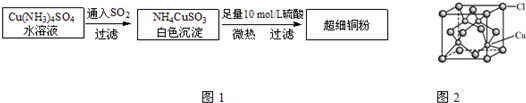
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
⑴超细铜粉的某制备方法如下:
①[Cu(NH3)4]SO4中所含的化学键有 、 、 ,
N、O、S三种元素的第一电离能大小顺序为: > > 。(填元素符号)
②NH4CuSO3中的金属阳离子的核外电子排布式为: 。
③ NH3分子中N原子的杂化方式为: 。
④与SO2互为等电子体的分子有 (写一种)。
⑵氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通人一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①CuCl的晶胞结构如下图所示,其中Cl原子的配位数为_________。
②CuCl的熔点比CuO的熔点 。(填“高”或“低”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com