
【题目】
(1)按如图所示操作,充分反应后:
①Ⅰ中发生反应的离子方程式为;
②Ⅱ中铜丝上观察到的现象是;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为 .
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应物中还原产物是;若反应中转移了0.3mol电子,则氧化产物的质量是g.
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl﹣ , 这个事实说明FeBr2的溶液中具有还原性粒子的还原性强弱为 .
(4)黑火药爆炸时发生反应:2KNO3+S+3C═K2S+N2↑+3CO2↑,2mol KNO3氧化碳的物质的量为 .
【答案】
(1)Fe+Cu2+═Fe2++Cu,红色铜丝上有白色金属Ag附着,Ag+>Cu2+>Fe2+
(2)NO,4.8
(3)Fe2+>Br﹣
(4)2.5
【解析】解:(1)①发生Fe与硫酸铜的置换反应生成Cu和硫酸亚铁,离子反应为Fe+Cu2+═Fe2++Cu。
故答案为:Fe+Cu2+═Fe2++Cu;
②发生Cu与硝酸银的置换反应,该反应为Cu+2AgNO3═Cu(NO3)2+2Ag,观察到红色铜丝上有白色金属Ag附着。
故答案为:红色铜丝上有白色金属Ag附着;
③由两个反应可知,得到电子的为氧化剂,还有剂对应的产物为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为Ag+>Cu2+>Fe2+,故答案为:Ag+>Cu2+>Fe2+;(2)硝酸具有强氧化性,H2S具有较强还原性,二者反应氧化还原反应,故NO为还原产物、S为氧化产物,若反应过程中转移了0.3mol电子,由电子转移守恒,可知生成S的物质的量为: ![]() =0.15mol,故生成S的质量为:0.15mol×32g/mol=4.8g。
=0.15mol,故生成S的质量为:0.15mol×32g/mol=4.8g。
故答案为:NO;4.8;
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl﹣,说明还原性:Fe2+>Br﹣。
故答案为:Fe2+>Br﹣;
(4)该反应中S元素化合价由0价变为﹣2价、N元素化合价由+5价变为0价、C元素化合价由0价变为+4价,2mol KNO3得到10mol电子,氧化碳 ![]() =2.5molC。
=2.5molC。
故答案为:2.5.
本题考查了氧化还原反应。解此题的关键是熟练掌握氧化还原反应的原理。(1)①Fe与硫酸铜发生置换反应生成Cu和硫酸亚铁;②发生Cu与硝酸银的置换反应,观察到红色铜丝上有白色金属Ag附着;③得到电子的为氧化剂,还有剂对应的产物为氧化产物,氧化剂的氧化性大于氧化产物的氧化性;(2)硝酸具有强氧化性,H2S具有较强还原性,NO为还原产物、S为氧化产物;(3)还原性:Fe2+>Br﹣;(4)反应中S元素化合价由0价变为﹣2价、N元素化合价由+5价变为0价、C元素化合价由0价变为+4价.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m:n
B.25℃,101KPa时,1Kg气体A与1Kg气体B的分子数比为n:m
C.同温同压下,气体A与气体B密度比为n:m
D.标准状况下,等质量的A与B的体积比为n:m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素R的最高正价与最低负价的代数和为4,由此可以判断( )
A. R一定是第四周期元素
B. R一定是ⅣA族元素
C. R气态氢化物化学式为H2R
D. R的气态氢化物比同周期其他元素气态氢化物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值.下列说法正确的是( )
①1.0L1.0mo1L﹣1的NaAlO2水溶液中含有的氧原子数为2NA
②过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
③密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
④.235g核素 ![]() U发生裂变反应:
U发生裂变反应: ![]() U+
U+ ![]() n
n ![]()
![]() Sr+
Sr+ ![]() Xe+10
Xe+10 ![]() n,净产生的中子(
n,净产生的中子( ![]() n)数为10NA
n)数为10NA
⑤氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
⑥铜粉溶于1L0.5mol/L稀硝酸中,当生成标况下2.24LNO时,溶液中的氮原子数为0.4NA个
⑦标准状况下,11.2升氯气溶于水,转移电子数为0.5NA
⑧12g石墨和C60的混合物中质子总数一定为6NA
⑨25℃时,1L molL﹣1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子.
A.②⑥⑧
B.①②⑥
C.③⑦⑧
D.①⑤⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量. 
(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的(填“正极”或“负极”),并写出B极发生反应的电极反应式 .
(2)电解开始一段时间后,在U形管中可观察到的现象 .
并写出该电解反应总的离子方程式 .
(3)实验中还需测定的数据是(填写序号).
①A极的质量增重mg ②B极的质量增重mg
(4)铜的相对原子质量为:(用含有m、V的计算式表示).
(5)如果用碱性(KOH为电解质)甲烷燃料电池作为电源进行实验,放电时负极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属原子晶体,是一种超强透明材料,可以由反应Al2O3+C+N2 ![]() 2AlON+CO合成,下列有关说法正确的是( )
2AlON+CO合成,下列有关说法正确的是( )
A.氮氧化铝中氮的化合价是﹣3
B.反应中氧化产物和还原产物的物质的量之比是1:2
C.反应中每生成5.7gAlON同时生成1.12LCO
D.AlON和CO的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Fe2+和Na+ . 某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是( ) 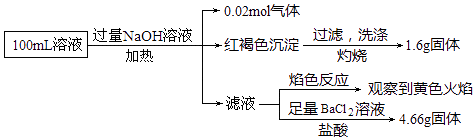
A.原溶液中c(Fe3+)=0.2molL﹣1
B.SO42﹣、NH4+、Na+一定存在,CO32﹣一定不存在
C.要确定原溶液中是否含有Fe2+ , 其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+
D.溶液中至少有4种离子存在,其中Cl﹣一定存在,且c(Cl﹣)≥0.2molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com