
【题目】在101 kPa时,氢气在1.0 mol氧气中完全燃烧,生成2.0 mol液态水,放出571.6 kJ的热量,氢气的标准燃烧热ΔH为____,表示氢气标准燃烧热的热化学方程式为________
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】335℃时,在恒容密闭反应器中1.00mol![]() 催化脱氢的反应过程如下:
催化脱氢的反应过程如下:
反应1:![]()
反应2:![]()
测得![]() 和
和![]() 的产率
的产率![]() 和
和![]() (以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
(以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
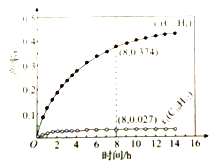
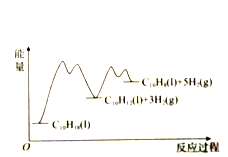
A. 使用催化剂能改变反应历程
B. 更换催化剂后![]() 、
、![]() 也会随之改变
也会随之改变
C. 8h时,反应1、2都未处于平衡状态
D. ![]() 显著低于
显著低于![]() ,是由于反应2的活化能比反应1的小,反应1生成的
,是由于反应2的活化能比反应1的小,反应1生成的![]() 很快转变成
很快转变成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是实验室中常用于制备和干燥气体的装置:
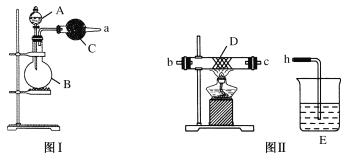
(1)甲同学用图Ⅰ装置、铜和稀硝酸制备并收集干燥的NO气体:
①B中反应的离子方程式为___;
②收集NO气体的方法为___。
(2)乙同学用图Ⅰ装置制取NH3和O2的混合气体,用图Ⅱ装置验证氨的某些性质:
往A中加入浓氨水,B中加入Na2O2固体,C中加入碱石灰,D内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器:
①实验中观察到D内有红棕色气体出现,证明氨气具有___(填“氧化性”或“还原性”)。
②D中反应的化学方程式为___、___。
③为防止NO2污染环境,E装置中装的试剂可以是___。
(3)丙同学用图1、铜和浓硫酸制取SO2,则需要增加___(填仪器名称)。实验中他们取6.4g铜片和3mL8mol/L浓硫酸放在圆底烧瓶,反应结束后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:___。实验中若有mg铜参加了反应,转移电子的数目为___。
②实验结束后发现铜片未完全溶解但硫酸剩余的原因是___。
③下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是___(填字母)。
a.硫酸钠溶液 b.氯化钡溶液 c.银粉 d.碳酸氢钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨作为一种潜在的清洁汽车燃料,它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。请回答下列问题:
Ⅰ.已知反应N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
2NH3(g)的活化能Ea1=akJ/mol,相关化学键键能数据如下:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 436 | 946 | 391 |
(1)反应2NH3(g)![]() N2(g)+3H2(g)的活化能Ea2=______kJ/mol(用含a的代数式表示);
N2(g)+3H2(g)的活化能Ea2=______kJ/mol(用含a的代数式表示);
(2)已知:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
则△H1、△H2、△H3三者之间的关系为:△H3= ______________ ;
Ⅱ.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,工作原理如图所示。
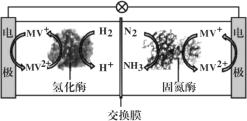
(3)负极的电极反应式为_______________;
(4)当电路中通过3mol电子时,可产生氨气的体积(标况下)为_______L;正极区中n(H+)______(填“增加”、“减少”或“不变”);
(5)该装置在高温下不能正常工作,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于____区。
(2)Fe-Cr-Al合金可作为汽车尾气催化剂的载体,汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为____。HNO3的酸性强于HNO2的原因为___。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为___(用含π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。
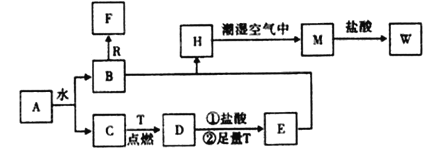
(1)物质A的化学式为___。
(2)B和R在溶液中反应生成F的离子方程式为___。
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,A可以作为呼吸面具的___。
(5)W和T反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.少量的二氧化碳气体通入足量烧碱溶液中反应CO2+OH-=HCO3-
C.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.向碳酸钙中滴加醋酸溶液:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在_____________________范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为_____________________________________________________________。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为_________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 2S2O32-+I2=2I-+S4O62-
则溶液中铁元素的总含量为_________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会_______ (填“偏高” “偏低” “不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生反应:xA(g)+B(g)![]() 2C(g) ΔH<0,A、C的物质的量随时间变化的关系如下表所示。下列有关说法正确的是( )
2C(g) ΔH<0,A、C的物质的量随时间变化的关系如下表所示。下列有关说法正确的是( )
时间/min | n(A)/mol | n(C)/mol |
0 | 0.3 | 0 |
1 | 0.15 | 0.15 |
2 | 0.1 | 0.2 |
3 | 0.1 | 0.2 |
A.x=1
B.反应开始2 min内,用B表示的反应速率为0.05 mol·L-1·min-1
C.反应进行到1 min时,反应体系达到化学平衡状态
D.A的正反应速率等于C的逆反应速率时,反应体系达到化学平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com