
【题目】铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃, 易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________。
(2)弯曲的a管所起的作用是_____________________;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是_____________________________________。
(3)导管b 口应与_______________ (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为______%。
(5)由上分析数据和计算得出结论:
①用此装置制得的无水氯化铁含铁_________偏高,偏低),显然其中含有较多________的杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是___________________。
【答案】2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O平衡气压,便于液体能顺利流下防止产物降温固化造成导管堵塞F37.17%偏高FeCl2在装置A、 B间加装一个盛有饱和食盐水的洗气瓶
【解析】
(1)高锰酸钾和浓盐酸反应生成氯化锰和氯化钾和氯气和水,离子方程式为: 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(2)弯曲的a管可以平衡分液漏斗和圆底烧瓶中的气压,便于液体能顺利流下;装置采用较粗的导管来连接庄铁粉的硬质玻璃管和广口瓶,是为了防止产物降温固化造成导管堵塞。 (3)因为空气中的水蒸气对氯化铁有影响,所以用盛有碱石灰的干燥管连接,所以连接F管口。 (4)红棕色固体为氧化铁,其物质的量为2.40/160=0.015mol,则样品中铁的物质的量为0.03mol,质量为0.03×51.68克,铁元素的质量分数为1.68/4.52=37.17% 。(5) ①在氯化铁中铁的质量分数为56/162.5=34.46%,所以说明用此装置制得的氯化铁含铁偏高。显然其中含有较多的FeCl2 ;②要想得到纯净的氯化铁,可以在装置A、 B间加装一个盛有饱和食盐水的洗气瓶,除去氯气中含有的氯化氢气体。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是:
A. H2O和D2O互为同位素
B. 金刚石和石墨互为同分异构体
C. 所有烷烃互为同系物
D. 乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢裂解制取氢气的反应为2H2S(g)![]() 2H2(g)+S2(g)。向恒容密闭容器中充入一定量的H2S气体,测得体系中气体的平衡组成与温度的关系如图所示。下列说法正确的是
2H2(g)+S2(g)。向恒容密闭容器中充入一定量的H2S气体,测得体系中气体的平衡组成与温度的关系如图所示。下列说法正确的是

A. 该反应平衡常数随温度升高而增大
B. M点时容器内气体总压强比N的大
C. M点时,H2S的平衡转化率为50%
D. 维持M点温度不变,向容器中再充入0.2molH2S、0.2molH2、0.1molS2(g),则v(正) = v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1L1.0mo1L-1的NaAlO2水溶液中含有的氧原子数为2NA
B. 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
C. Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA
D. 室温下,将9g铝片投入0.5L 18.4molL-1的H2SO4中,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
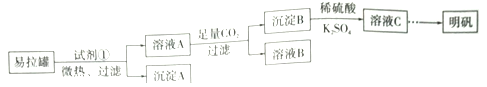
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。

(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前三周期的一部分:

(1)判断 Y ____ Z _____ R _____(写元素符号)。
(2)写出X的氢化物的化学式:_________,W的氢化物的化学式_________,其沸点比较: ________>________ ______________ (填化学式)
(3)下图是X的基态原子的电子排布图,其中有一个是错误的,它不能作为基态原子的电子排布 图是因为它不符合________。


(4)以上五种元素中,________(填元素符号)元素第一电离能最大。_____元素电负性最大,Y的基态原子的电子排布式为________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com