
【题目】写出相关的反应方程式:
(1)由可溶性铝盐制取氢氧化铝,需加入的试剂为:________;反应方程式为:_____________。
(2)白色的Fe(OH)2在空气中发生的颜色变化为___________。反应的化学方程式为:________。
(3)氯气与铁反应:_________。
【答案】氨水 AlCl3 + NH3·H2O = NH4Cl + Al(OH)3 ↓ 白色变成灰绿色,最后变成红褐色 4Fe(OH)2 + 2H2O + O2 = 4Fe((OH)3 2Fe+3Cl2![]() 2FeCl3
2FeCl3
【解析】
(1)强碱可以和氢氧化铝沉淀反应,所以一般向铝盐中加入过量的可溶性弱碱如氨水,来制取氢氧化铝,反应方程式为AlCl3 + NH3·H2O = NH4Cl + Al(OH)3 ↓;
(2)白色的Fe(OH)2 会被空气中的氧气氧化成Fe(OH)3红褐色沉淀,所以可以观察到:白色变成灰绿色,最后变成红褐色;化学方程式为4Fe(OH)2 + 2H2O + O2 = 4Fe((OH)3;
(3)氯气与铁反应生成氯化铁,化学方程式为2Fe+3Cl2![]() 2FeCl3。
2FeCl3。


科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I- >Fe2+>Br-,向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
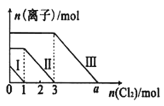
A.a值等于6
B.线段Ⅰ代表Br-的变化情况
C.线段Ⅲ代表Fe2+的变化情况
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:
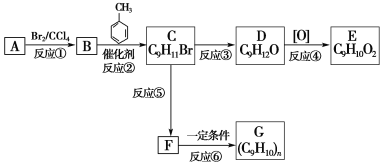
已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平)。
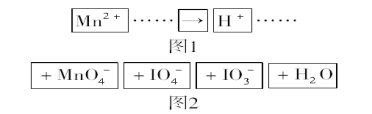
对该氧化还原反应型离子方程式,说法不正确的是( )
A.IO4-作氧化剂具有氧化性
B.氧化剂和还原剂的物质的量之比为5∶2
C.若有2molMn2+参加反应时则转移10mol电子
D.氧化性:MnO4->IO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式为![]() ,关于该有机物下列叙述正确的是
,关于该有机物下列叙述正确的是
A. 不能使酸性KMnO4溶液褪色
B. 不能使溴水褪色
C. 在加热和催化剂作用下,最多能和4 mol H2反应
D. 易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

回答下列问题:
(1)所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为_____________(填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸 D.FeCl3溶液
此步涉及反应的离子方程式为_____________________________________。
(2)反应发生后装置B中发生反应的化学方程式是______________________________。D装置的作用:________________________________________________。
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
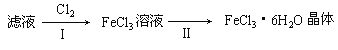
①用离子方程式表示步骤I中通入Cl2的作用__________________________________;
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。向一支装有该未 知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理_______________(填“合理”或“不合理”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如下实验流程:在一个小烧杯里,加入20gBa(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如图所示,回答下列问题:

(1)实验中玻璃棒的作用是___________________。
(2)浸有稀硫酸的棉花的作用是___________________。
(3)请写出该反应的化学反应方程式:______________________________。
(4)通过______________________________现象,说明该反应为___________________(填“吸热”或“放热”)反应,这是因为反应物的总能量___________________(填“>”“<”或“=”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO2

C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3 具有热不稳定性
D. 充分反应后,锥形瓶内有 NO3-存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,依次进行如下实验:
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液;
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③继续滴加amL0.1mol/L稀盐酸,至溶液的pH=7。
下列说法正确的是
A.①中溶液的pH=1
B.②中反应后溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.③中,a=20
D.③中,反应后溶液:c(Na+)=c(CH3COO-)+c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com