
(10分)科学家预言,燃料电池将是2l世纪获得电力的重要途径。一种甲醇燃料电池是采用铂或炭化钨作电极,在硫酸电解液中直接加入净化后的甲醇。同时向一个电极通入空气。
回答如下问题:
(1)配平电池放电时发生的化学反应方程式:
□CH3OH+□O2→□CO2+□H2O
(2)在硫酸电解液中,CH3OH(C为-2)失去电子。此电池的正极发生的反应是 ,负极发生的反应是 。
(3)电解液中的H+向 极移动;向外电路释放电子的电极是 。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其主要有两点:首先燃料电池的能量转化效率高,其次是 。
(5)甲醇燃料电池与氢氧燃料电池相比.其主要缺点是甲醇燃料电池的输出功率较低.但其主要优点是 。
(1)2 3 2 4 (2)O2+4H++4e-===2H2O CH3OH+H2O-6e-===CO2↑+6H+
(3)正 负极 (4)减少污染 (5)甲醇比H2廉价,甲醇是液态(常温下),易于运输和保存
【解析】(1)甲醇中碳原子是-2价的,氧化产物中碳原子是+4价的,所以1mol甲醇失去6mol电子,而1mol氧气只能得到4mol电子,所以氧化剂和还原剂的物质的量之比是3︰2,所以方程式为2CH3OH+3O2=2CO2+4H2O.
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以氧气再正极通入,甲醇再负极通入。由于是酸性溶液,所以电极反应式分别为)O2+4H++4e-===2H2O、CH3OH+H2O-6e-===CO2↑+6H+。
(3)原电池中阳离子向正极移动,负极失去电子,向外电路释放电子。
(3)由于生成物是水和CO2,没有污染。
(4)由于甲醇比H2廉价,且甲醇是液态(常温下),易于运输和保存。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1| 1 |
| 2 |
| 1 |
| 2 |

| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1= CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为| 4a2 |
| V2 |
| 4a2 |
| V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列问题:
(1)这种电极放电时发生的化学反应方程式是____________________________________。
(2)此电极的正极发生的电极反应式是__________;负极发生的电极反应式是__________。
(3)电解液中的H+向__________极移动;向外电路释放电子的电极是__________。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
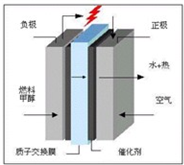
(8分)科学家预言,燃料电池将是21世纪获得电源的重要途径。近几年开发的甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
(1)![]() 电极上的反应式为 ;
电极上的反应式为 ;
(2)![]() 电极上的反应式为 ;
电极上的反应式为 ;
(3)原电池的总反应是 ;
(4)若电池工作时电路中通过4mol电子,则用去的![]() 在标准状况下的体积为 L。
在标准状况下的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com