
某课外小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):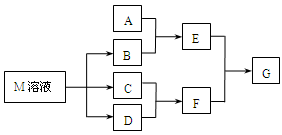
(1)写出用惰性电极电解M溶液的离子方程式 。
(2)写出F的电子式 。
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是 。
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 。若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为 。
(1)2Cl-+2H2O 2OH-+H2↑+Cl2↑ (2)
2OH-+H2↑+Cl2↑ (2)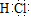 (3)水玻璃(4)溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。(5)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ (分步写且全正确给分)(6)3Cl2+8NH3=N2+6NH4Cl(7)c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
(3)水玻璃(4)溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。(5)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ (分步写且全正确给分)(6)3Cl2+8NH3=N2+6NH4Cl(7)c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
解析试题分析:有生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰,可知,M为NaCl,C为H2,D为Cl2。B为NaOH,F为HCl。(1)电解氯化钠溶液离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑(2)F为HCl,共价化合物,电子式为
2OH-+H2↑+Cl2↑(2)F为HCl,共价化合物,电子式为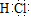 。(3)A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,与氢氧化钠的反应的产物为硅酸钠,俗称水玻璃。(4)Al能够与碱溶液发生反应,产生偏铝酸钠,当逐滴加入HCl时,产生氢氧化铝沉淀,当沉淀达到最大值是,继续滴加盐酸,沉淀溶解生成氯化铝,故能看到的实验现象是溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。(5)根据产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E 可知,E为氢氧化铁。A中含有亚铁离子。 4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。(6)根据,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露可知,E为氨气,E与D反应的化学方程式是3Cl2+8NH3=N2+6NH4Cl。(7)由图象可知,在A中加入NaOH,先没有生成沉淀,则溶液中存在H+,继续加入NaOH后沉淀的质量不变,应含有NH4+,沉淀最后溶解,应为Al3+,则一定不含CO32-,一定含有SO42-。根据图像可知,c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
。(3)A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,与氢氧化钠的反应的产物为硅酸钠,俗称水玻璃。(4)Al能够与碱溶液发生反应,产生偏铝酸钠,当逐滴加入HCl时,产生氢氧化铝沉淀,当沉淀达到最大值是,继续滴加盐酸,沉淀溶解生成氯化铝,故能看到的实验现象是溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。(5)根据产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E 可知,E为氢氧化铁。A中含有亚铁离子。 4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。(6)根据,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露可知,E为氨气,E与D反应的化学方程式是3Cl2+8NH3=N2+6NH4Cl。(7)由图象可知,在A中加入NaOH,先没有生成沉淀,则溶液中存在H+,继续加入NaOH后沉淀的质量不变,应含有NH4+,沉淀最后溶解,应为Al3+,则一定不含CO32-,一定含有SO42-。根据图像可知,c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
考点:无机物的推断;位置结构性质的相互关系应用 。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:填空题
某新型无机非金属材料A,由两种非金属元素组成,其中所含元素的化合价为其最高正价或最低负价,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。A可由化合物B经下列反应制得:①B+NH3→C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解得到A。为探究B的组成,进行了下图所示的转化实验,图中G、F、H均为难溶于水的物质,且为白色粉末,图中字母代表的均为中学化学常见的物质。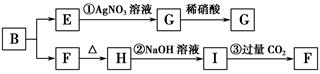
请回答下列问题:
(1)写出化合物B和化合物G的化学式________、________。
(2)A可能所属的晶体类型是________,在A晶体中,每个显正价原子周围结合的另一种原子的个数是________。
(3)写出反应②的离子方程式:_____________________________________________。
(4)写出C经隔绝空气高温分解得到A的化学方程式:_________________________________________________。
(5)分析反应③,你能得出的结论是________(合理即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出)。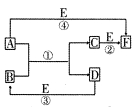
(1)若A、D、E是短周期的非金属单质,且 A、D所含元素同主族,A、E含元素同周期,已知D单质在电子工业中有重要作用,则D的原子结构示意图为________;F的分子构型为________;反应①的化学方程式为__________________。
(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,写出反应③的化学方程式_ _________________;足量的A与B溶液充分反应后,生成物C中金属阳离子的检验方法为__________________;若以惰性电极电解B的水溶液,当阴极增重9.6g时,阳极生成气体在标准状况下的体积为________,写出电解B的水溶液的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。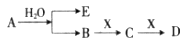
请回答下列问题:
(1)B中所含化学键的类型是______________;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式____________________。
(3)①C也可转化为B,写出该转化的化学方程式_______________;
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。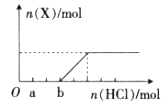
请回答:a点溶液中所含溶质的化学式为__________,b点溶液中各离子浓度由大到小的关系是___________________。
(5)将C溶液与氢氧化钡溶液混合可得不溶物F,F的 =2.5×
=2.5×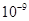 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol·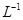 的BaCl2溶液中,其
的BaCl2溶液中,其 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·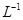 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。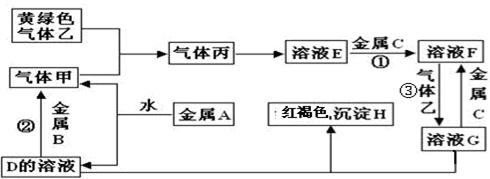
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:F中的溶质 ______________; 丙____________。反应③离子方程式
H受热分解后的固体产物与金属B高温下的化学方程式:_______________________A与水反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题: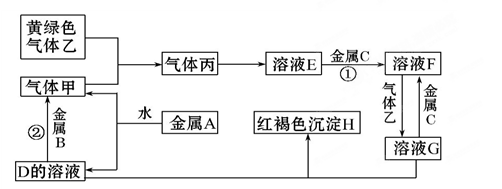
(1)写出下列物质的化学式:
A_____、乙____ ,C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是__________。
(2)写出反应②的化学方程式: ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。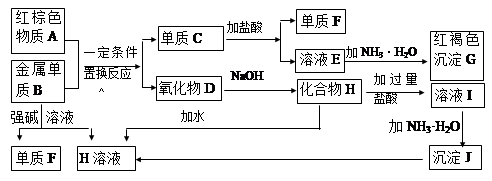
(1)G加热可分解生成A,A的化学式为________,写出物质A的一种用途 。
(2)写出单质B与强碱溶液反应的离子方程式_______________________________________,写出由沉淀J生成 H溶液的离子方程式___________________________________________.。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式_______________________,白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式 。
(4)溶液I中所含金属离子是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种物质均含有同一种元素,它们之间有如下转化关系:
(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀。写出下列过程的离子方程式: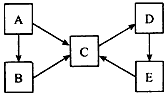
①B的水溶液呈酸性____________。 ②C→D_______________。 ③E→C________________。
(2)若A~E均为化合物。A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法。
①A的电子式为__________。
②电解D的水溶液时,反应的离子方程式为________________。
③生铁浸入D溶液而发生锈蚀,正极的电极反应为________________。
(3)若A为单质,C、D的相对分子质量相差16,0.1mol/L E溶液中只有3种离子,且常温下溶液中的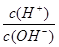 =1012。
=1012。
①B→C的化学方程式为: 。
②A→C的反应中,每转移1 mol e-就会吸热45 kJ,写出该反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图: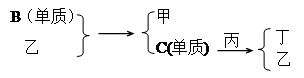
又知甲、乙、丙分子均含有10个质子。
(1)根据以上条件,可以确定A、B、C、D四种元素中三种,不能被确定的第四种元素是 (填写选项的编号,下同)(①A ②B ③C ④D)
写出转化关系图中已确认的反应的化学方程式:
(2)以下四个补充条件中的任何一个都可以进一步确定第四种元素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是 。
A.化合物甲与丙、乙与丙均能够发生反应
B.化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
C.通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应。
D.单质C和化合物丁不能共存。
依据该条件推断,第四种元素在周期表中的位置为 。
(3)按(2)中的另外三个补充条件推断第四种元素。丙的空间构型为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com