
已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。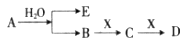
请回答下列问题:
(1)B中所含化学键的类型是______________;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式____________________。
(3)①C也可转化为B,写出该转化的化学方程式_______________;
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。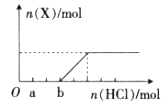
请回答:a点溶液中所含溶质的化学式为__________,b点溶液中各离子浓度由大到小的关系是___________________。
(5)将C溶液与氢氧化钡溶液混合可得不溶物F,F的 =2.5×
=2.5×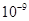 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol·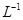 的BaCl2溶液中,其
的BaCl2溶液中,其 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·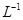 。
。
(1)(极性)共价键、离子键(2分)(多答、错答、漏答不得分)
(2)2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g) △H=-20a kJ·mol-1(2分)
(3)①Ca(OH)2 + Na2CO3=CaCO3↓ + 2NaOH (2分) [用Ba(OH)2代替Ca(OH)2也可。]
②OH- + HCO3- =CO32-+H2O(2分)
(4)Na2CO3、NaCl(2分)(多答、错答、漏答不得分)
c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)(2分)[c(CO32-)可写可不写,不作评分依据。]
(5)不变(1分) 5.0×10-9(2分)
解析试题分析:由转化关系知:A为Na2O2,E为O2,X为CO2,B为NaOH,C为Na2CO3,D为NaHCO3。(1)NaOH中存在(极性)共价键、离子键。(2)书写热化学方程式要注明物质的状态,要注意热量值与物质的化学计量数成比例。(3)C转化为B为复分解反应,书写时应注意反应的条件。酸式盐NaHCO3与NaOH反应生成正盐Na2CO3与H2O。(4)NaOH与CO2反应,CO2的量由少到多,所得溶液中的溶质可能有以下几种情况:NaOH与Na2CO3、Na2CO3、Na2CO3与NaHCO3、NaHCO3四种。根据与盐酸反应量的关系,可确定O点溶液中溶质为NaOH与Na2CO3,且两者物质的量之比为1:2。O点→a点发生反应:NaOH+HCl=NaCl+H2O,a点→b点发生反应:Na2CO3+HCl=NaHCO3+NaCl。b点溶液中各离子浓度由大到小的关系是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。(5)不溶物F为BaCO3,Ksp仅与温度有关,该沉淀放入0.1 mol·L-1的BaCl2溶液中,其Ksp不变;c(CO32-)=Ksp/ c(Ba2+)=2.5×10-9/0.5=5.0×10-9 mol·L-1。
考点:本题主要考查流程图中物质的推导,涉及知识有盐类水解,热化学方程式书写,Ksp的计算。


科目:高中化学 来源: 题型:填空题
A~G各物质间的关系如图,其中B、D为气态单质。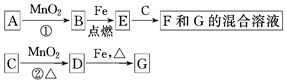
请回答下列问题。
(1)物质C和E的名称分别为 、 ;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为 ;若只能在加热情况下进行,则反应物A应为 ;
(3)MnO2在反应①和反应②中的作用分别是 、 ;
(4)新配制的F溶液应加入 以防止其转化为G。检验G溶液中阳离子的常用试剂是 ,实验现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种温室气体,C的相对分子质量为78。请回答相关问题。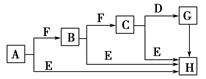
(1)下列对C的结构、性质推断中不正确的是 ( )。
| A.久置于空气中会变成白色 | B.具有强氧化性 |
| C.晶体中存在离子键与非极性键 | D.是一种碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如下图所示:
请回答下列问题:
(1)若A为金属单质,B为非金属氧化物,则该反应的化学方程式为 ;请写出质量数为26的A的一种核素符号 。
(2)若A为金属单质,B为黑色磁性晶体,则该反应的化学方程式为 ;请写出A与氢氧化钠溶液反应的离子方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):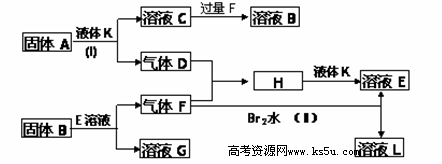
试回答:
(1)A的电子式为 ;所含化学键类型为 、 。(各1分)
(2)溴元素在周期表的位置 丁元素的阴离子结构示意图为 。(各2分)
(3)反应(I)的化学方程式为 。(2分)
(4)反应(II)的离子方程式为 。(2分)
(5)含1mol C的溶液中缓慢通入15.68 L的CO2(标况),所得溶液中溶质的物质的量之比为 (式量大的比式量小的)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有分子式为C10H10O2Br2的芳香族化合物X,X中苯环上有四个取代基,苯环上的一氯代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。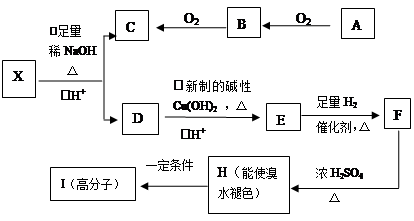
已知:
①在稀碱溶液中,连在苯环上的溴原子不易发生水解
②两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水反应:
CH3CH(OH) 2→CH3CHO +H2O
回答下列问题:
(1)X中官能团的名称是 ,C的结构简式为
(2)E→F反应类型是
(3)I的结构简式为 ;
(4)E不具有的化学性质 (选填序号)
a、取代反应 b、消去反应
c、氧化反应 d、1molE最多能与1mol NaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:
②B→C的化学方程式: ;
(6)同时符合下列条件的E的同分异构体共有 种,
a、苯环上的一氯代物有两种 b、不能发生水解反应 c、遇FeCl3溶液不显色
d、1molE最多能分别与1molNaOH和2molNa反应
其中核磁共振氢谱为六组峰,且峰面积比为3:2:2:1:1:1的一种结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课外小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):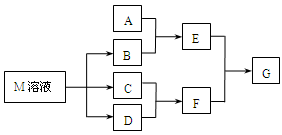
(1)写出用惰性电极电解M溶液的离子方程式 。
(2)写出F的电子式 。
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是 。
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 。若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。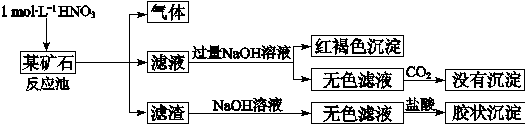
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)已知:通常状况下甲、乙、丙、丁为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③是工业制H的重要化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。请回答下列问题: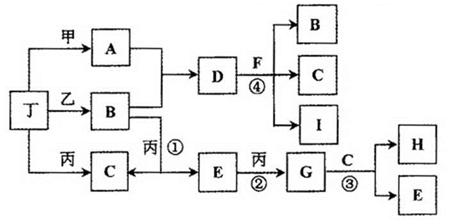
(1)反应④的化学方程式为 。
(2)B和E在一定条件下可发生反应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为 。
(3)在恒温恒压容器中加入一定量B,催化条件下发生反应B 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
(4)常温下,物质的量浓度相同的A、B、D三者的水溶液,由水电离出的c(OH-)大小顺序是(用A、B、D表示) 。
(5)惰性电极电解A和D的混合溶液,可生成丁单质和一种二元化合物M(与甲、乙所含元素相同),M为三角锥形分子,该反应的方程式为 。在碱性溶液中M与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物B和消毒剂ClO2气体,该反应的离子方程式为 。
(6)将Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是 mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com