
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),理由是_______________,溶液中各离子浓度大小关系是______。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为______________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42—物质的量浓度不小于0.01 mol·L-1,则溶液中CO32—物质的量浓度应≥________ mol·L-1。
(1)HCN B
(2)中性 水电离出的H+和OH-的浓度相等,CH3COONH4溶于水后,根据表1中的电离平衡常数,CH3COO-结合H+和NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+和OH-浓度相等,溶液呈中性 c(NH4+)=c(CH3COO-)>c(OH-)=c(H+)
(3)c(Na+)>c(CN-)>c(OH-)>c(H+)
(4)0.26
【解析】电离平衡常数越小,酸的酸性越弱,因此HCN酸性最弱;电离平衡常数只与温度有关,酸浓度越小,电离程度越大,加入CH3COONa和冰醋酸都会抑制CH3COOH的电离。由于醋酸与NH3·H2O的电离平衡常数相同,故NH4+、CH3COO-水解能力相同,CH3COONH4溶液呈中性,溶液中c(CH3COO-)=c(NH4+)>c(H+)=c(OH-)。NaCN和HCN混合溶液的pH>7,说明CN-的水解能力大于HCN的电离能力,故有c(Na+)>c(CN-)>c(OH-)>c(H+)。使SO42—浓度不小于0.01 mol·L-1则需使Ba2+浓度不大于  =1.0×10-8,所以CO32—浓度应大于等于
=1.0×10-8,所以CO32—浓度应大于等于  mol·L-1
mol·L-1


科目:高中化学 来源:2014年高考化学苏教版总复习 9-2 食品中的有机化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.甲烷、乙烯、乙醇和乙酸都能发生加成反应
B.欲将蛋白质从溶液中析出而又不改变它的性质,可加入(NH4)2SO4浓溶液
C.苯在一定条件下能发生加成反应,也可和溴水发生取代反应
D.蛋白质水解的最终产物是葡萄糖
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的CH3COOH溶液,其pH逐渐减小,图中a,b,c三点的pH为实验中所测得,下列有关说法中一定正确的是 ( )
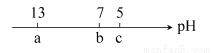
A.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.当pH=7时,所加CH3COOH溶液的体积为10 mL
C.当5<pH<7时,溶液中c(CH3COO-)>c(Na+)
D.继续滴加0.1 mol·L-1的CH3COOH溶液,溶液的pH最终可以变化至1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
水的电离平衡曲线如图所示,下列说法不正确的是( )
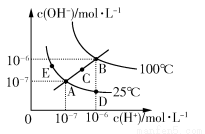
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
有关水的电离平衡的说法正确的是( )
A.水的离子积通常用KW来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大
B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离
C.盐溶于水对水的电离平衡均没有影响
D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合后的体积变化)( )
序号 | ① | ② | ③ | ④ |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
下列关于催化剂的说法不正确的是( )
A.温度越高,催化剂的催化效果越好
B.汽车排气管上的“催化转化器”能减少有害气体排放
C.催化剂可以改变化学反应速率,但反应前后质量和化学性质不变
D.锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
已知反应AsO43—+2I-+2H+ AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转。
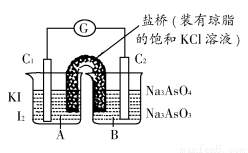
据此,下列判断正确的是( )
A.操作Ⅰ过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.操作Ⅰ过程中,C2棒上发生的反应为:AsO43—+2H++2e-=AsO33—+H2O
D.操作Ⅱ过程中,C1棒上发生的反应为:2I-=I2+2e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com