
����Ŀ��ʵ������Ҫ250 mL 0.5 moL��L��ϡ������Һ�������ܶ�Ϊ1.84 g/mL����������Ϊ98����Ũ�������ơ���ش��������⡣
��1�����������У��ò�������__________��
A��250 mL����ƿ B��500 mL����ƿ C��50 mL��Ͳ D��10 mL��Ͳ
��2����Ҫ�������ƣ������������⣬��ȱ�ٵ���������Ʒ��_______________________��
��3�� ����ƿ�ϳ��п��ߺ���������Ӧ�����¶ȣ�����ƿ��ʹ��ǰ������еIJ����ǣ�________��
��4�����dz������ƹ��̼������£�����ȴ����ϴ���ձ��е�Һ�壻����ȡ�����ܽ⣻�����ݣ���ҡ�ȣ�����Һ������ȷ�IJ���˳����________________________ (�����)��
���𰸡�B��C ��ͷ�ιܡ��ձ��������� ��© �ۢܢ٢ߢڢݢ�
��������
��1��ͨ����������Ũ�������������Ͳ��ѡȡ���������
��2������ʵ�鲽���������������
��3������ƿʹ��ǰ��Ҫ��©��
��4����������һ��Ũ����Һ����ȷ���������������
��1���ܶ�Ϊ1.84 g/mL����������Ϊ98����Ũ����
c=![]() mol/L������Ũ��������V=
mol/L������Ũ��������V=![]() ��ѡ����Ͳʱ��������ѡ������С������һ���������Ͳ�������ò�������B��C��
��ѡ����Ͳʱ��������ѡ������С������һ���������Ͳ�������ò�������B��C��
����B��C��
��2����Ҫ�������ƣ������������⣬��ȱ�ٵ���������Ʒ�ǽ�ͷ�ιܡ��ձ�����������
��Ϊ����ͷ�ιܡ��ձ�����������
��3�� ����ƿ�ϳ��п��ߺ���������Ӧ�����¶ȣ�����ƿ��ʹ��ǰ������еIJ����ǣ���©����Ϊ����©��
��4�����dz������ƹ��̼������£�����ȴ����ϴ���ձ��е�Һ�壻����ȡ�����ܽ⣻�����ݣ���ҡ�ȣ�����Һ������ȷ�IJ���˳��Ӧ�Ӽ��㡢��ȡ���ܽ⡢ת�ơ������������ȥѡ��������ȷ�IJ���˳���Ǣۢܢ٢ߢڢݢޡ�
��Ϊ���ۢܢ٢ߢڢݢޣ�


 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���Ƿ���ȷ
��1�� | ��2�� | ��3�� | ��4�� |
___ | ___ | ___ | ___ |
��1��22.4LO2��һ������6.02��1023��������
��2����80gNaOH����1Lˮ�У�������Һ��NaOH�����ʵ���Ũ��Ϊ2mol/L
��3��18gH2O�ڱ�״���µ������22.4L
��4���ڱ�״��ʱ��20mLNH3��60mLO2�����ķ��Ӹ�����Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ������
Ԫ�ش��� | X | Y | Z | W |
ԭ�Ӱ뾶 | 160 | 143 | 70 | 66 |
��Ҫ���ϼ� |
|
|
|
|
����������ȷ����
A. X�ĵ縺�Դ���Y�ĵ縺��
B. W���⻯���ͬ������Ԫ�ص��⻯���ȶ�������ΪW���⻯���д������
C. Y������������Ӧ��ˮ����������ϡ�����ϡ��ˮ
D. W�ķǽ����Ա�Yǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.2 mol NaOH��0.1 mol Ba(OH)2����Һ�г����ȶ���ͨ��CO2���壬��ͨ����������Ϊ6.72 L����״���£�ʱ����ֹͣ��������һ�����У���Һ�����ӵ����ʵ�����ͨ��CO2����������ϵ��ȷ��ͼ���ǣ�������ܽ���Բ��ƣ��� ��
A.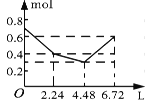 B.
B. C.
C.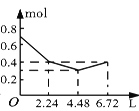 D.
D.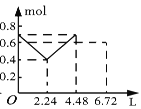
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧԭ��![]() �������������������Ⱦ�����¶�
�������������������Ⱦ�����¶�![]() ��
��![]() ʱ,�ֱ�
ʱ,�ֱ�![]() ��
��![]() ���������Ϊ1L���ܱ������У����
���������Ϊ1L���ܱ������У����![]() ��ʱ��仯��ͼ������˵����ȷ���� ( )
��ʱ��仯��ͼ������˵����ȷ���� ( )
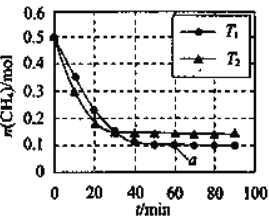
A. ![]()
B. ![]()
C. a��ʱ![]() ��ת����Ϊ
��ת����Ϊ![]()
D. �¶�Ϊ![]() ����ƽ��ʱ��Ӧ����ЧӦΪ
����ƽ��ʱ��Ӧ����ЧӦΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶���,���ݻ�Ϊ1L���ܱ������г���![]() ��
��![]() ����
����![]() ���
���![]() �����ʵ�����ʱ��ı仯��ͼ��ʾ��(��֪�����¶���,�÷�Ӧ��ƽ�ⳣ��
�����ʵ�����ʱ��ı仯��ͼ��ʾ��(��֪�����¶���,�÷�Ӧ��ƽ�ⳣ��![]() )����˵����ȷ���� ( )
)����˵����ȷ���� ( )
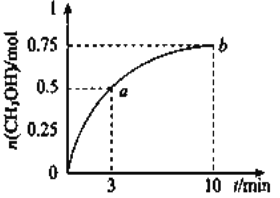
A. ![]()
B. ��b����Ӧ��״̬Ϊ��ѧƽ��״̬
C. ![]() ����������,��a���ڵ�b
����������,��a���ڵ�b
D. ������ƽ��״̬ʱ![]() ,�ɱ���������������,�����¶�
,�ɱ���������������,�����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(��Ҫ�ɷ�ΪAl2O3����SiO2�����������������)Ϊԭ���Ʊ�������������������������ͼ��ʾ����ش��������⣺
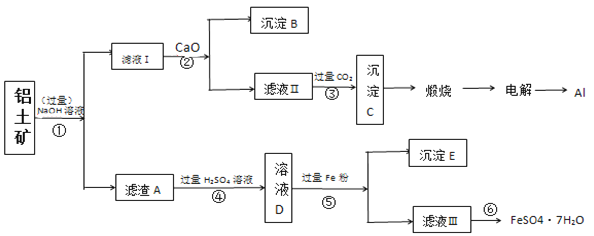
��1����������������ʵķ���_______��
��2����Һ������Ҫ����������______������B�Ļ�ѧʽ____������۵����ӷ���ʽ��____��
��3������ݼ�����������۵�Ŀ��___�������ӷ���ʽ���ͣ�
��4��������Һ���еĽ��������ӵķ����ǣ�_____��
��5����Һ��________��_______�����˵õ������������壬����ʱ��Ҫ�IJ���������___�����ţ���
��6�����������������̲ⶨ����������Ԫ�ص�����������ȡ10g��Ʒ�����յõ�5.56g��FeSO4��7H2O���壬������������Ԫ�ص���������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�á���ش�����������
��1��һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£�
��CaSO4��s��+CO��g��![]() CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
��1/4CaSO4��s��+CO��g��![]() 1/4CaS��s��+CO2��g�� ��H = - 47.3kJmol-1
1/4CaS��s��+CO2��g�� ��H = - 47.3kJmol-1
��ӦCaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) ��H= kJmol-1��
CaS(s)+3CO2(g) ��H= kJmol-1��
ƽ�ⳣ��K������ʽΪ ��
��2��ͼ1Ϊ���ܱ�������H2S����ֽ�����H2��S2(g)��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��
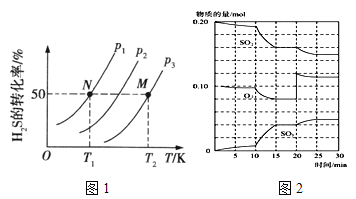
ͼ1��ѹǿp1��p2��p3�Ĵ�С˳��Ϊ �������� ���÷�Ӧƽ�ⳣ���Ĵ�С��ϵΪK(T1) K(T2) (�>������<����=��)�������� ��
��3����һ�������£���������������������·�Ӧ��2SO2(g)��O2(g) ![]() 2SO3(g) ��H��0
2SO3(g) ��H��0
��600��ʱ����һ�ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ2����Ӧ����ƽ��״̬��ʱ����� ��
����ͼ2�жϣ���Ӧ������20minʱ�����߷����仯��ԭ���� �������ֱ����10min��15min�����߱仯��ԭ������� ����д��ţ���
A�����˴��� B����С�������
C�������¶� D������SO3�����ʵ���
��4�������е�SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ�����Һ��c(Na��)= ���ú�����Ũ�ȵĴ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ��Ũ��������ڼ��������·������·�Ӧ(��Ӧ����ʽ����ƽ)��Cu+2H2SO4(Ũ)![]() CuSO4+A��+2H2O���������������⣺
CuSO4+A��+2H2O���������������⣺
(1)A���ʿ��Ե���������γɡ���AӦ������______(����ĸ������д)
a���� b�� �� c���� d������������ e������������
(2)�÷�Ӧ�б�������Ԫ����_________________���μӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______��
(3)д���÷�Ӧ�Ļ�ѧ����ʽ����˫���ű������ת�Ƶķ������Ŀ��____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com