
【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W |
原子半径 | 160 | 143 | 70 | 66 |
主要化合价 |
|
|
|
|
下列叙述正确的是
A. X的电负性大于Y的电负性
B. W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键
C. Y的最高价氧化物对应的水化物能溶于稀硫酸和稀氨水
D. W的非金属性比Y强
【答案】D
【解析】
在主族元素中,元素的最高化合价与其族序数相等,原子的电子层数越多其原子半径越大,根据元素化合价可知,W元素的化合价是-2价,没有最高正化合价+6价,则W是O元素,Z元素化合价为+5,+3,-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为N元素,X的化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第IIIA族,两者原子半径相差较小,可以知道两者位于同一周期相邻主族,因为X、Y的原子半径与W、Z的原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素,据此答题。
A.一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小,由推断可知Y为Al元素,X为Mg元素,所以电负性:Al>Mg,故A错误;
B.W为O元素,水比同族其他元素的氢化物稳定,是因为O的非金属性比同族其他元素的的非金属性强,与氢键无关,故B错误;
C.由推断可知Y为Al元素,Y的最高价氧化物对应的水化物为氢氧化铝,氢氧化铝为两性氢氧化物,可以与稀硫酸反应,但是与弱碱稀氨水不反应,故C错误;
D.由推断可知Y为Al元素,W为O元素,同一周期元素的非金属性逐渐增大,同一主族元素的非金属性逐渐减弱,所以非金属性O>Al,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】写出如下化学反应方程式,如果是离子反应,则写离子反应方程式:
(1)氯气通入石灰乳中制取漂白粉:_________________________________
(2)漂白粉生效:_________________________________
(3)饱和的碳酸钠溶液中通入二氧化碳:_________________________________
(4)过氧化钠与二氧化碳反应:_________________________________
(5)次氯酸见光分解:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素的基态价电子排布式为_____________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______________,提供孤电子对的成键原子是_____________。
③氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是__________________;氨是_________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______________键形成的晶体。
(4)某镍白铜合金的立方晶胞结构如图所示。
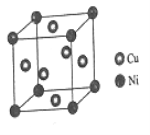
①晶胞中铜原子与镍原子的数量比为___________。
②若合金的密度为dg/cm3,晶胞边长a=______________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图所示装置在实验室欲制备乙酸乙酯。
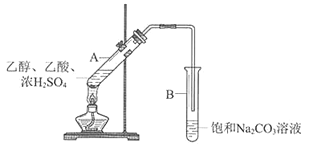
(1)B装置中,导管口略高于液面的目的是________________________
(2)为了改善反应过程中混合溶液变黑的现象,甲同学采用NaHSO4代替浓硫酸做催化剂(其他试剂及用量不变)来制备乙酸乙酯,NaHSO4可代替浓硫酸做催化剂的原因是__________________________________________________________
(3)下图是甲同学采用NaHSO4做催化剂,其他条件不变(其中乙酸用量为2 mL)不同质量的NaHSO4来制备乙酸乙酯的催化效果图,其中NaHSO4的质量为_______g时催化效果最好。

(4)乙同学实验时,在饱和NaCO3中滴加两滴酚酞,实验结束,取下试管B振荡,红色褪去。为探究褪色的原因,进行如下实验。
编号 | ① | ② | ③ |
实验 |
|
|
|
操作 | 充分振荡、静置 | 充分振荡、静置 | 充分振荡、静置、分液。取下层溶液,加入饱和Na2CO3溶液 |
现象 | 上层液体变薄,冒气泡,下层溶液红色褪去 | 上层液体不变薄,无气泡,下层溶液红色褪去 |
a试管①中产生气泡的原因是(用化学方程式解释)____________________________。
b对比实验①和②可得出的结论是___________________________________。
c针对实验②中现象,乙同学提出猜想:酚酞更易溶于乙酸乙酯。实验③中观察到__________________________________,证实乙的猜想正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 根据如表所列数据判断,错误的是
根据如表所列数据判断,错误的是
元素 |
|
|
|
|
X | 496 | 4562 | 6912 | 9543 |
Y | 578 | 1817 | 2745 | 11575 |
A. 元素X的常见化合价是![]() 价
价
B. 元素Y是ⅢA族元素
C. X单质的熔点高于Y单质的熔点
D. 若元素X处于第3周期,它的单质可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,在农药、制药行业中用途广泛。实验室合成原理为:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:

已知:①SOCl2沸点为78.8℃,SCl2 的沸点为50℃,且两种液体可互溶。
②SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的有气体产生。
(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是:⑥→__________→①,②←______________(某些仪器可以多次使用)。
(2)仪器a的名称是________,仪器b的作用是____________。
(3)本实验中制Cl2的离子方程式为___________________,本实验中制SO2的化学方程式为______________________,SOCl2与水反应的化学方程式为___________。
(4)实验结束后,从三颈烧瓶分离出SOCl2的实验操作名称是_________________。若反应中消耗Cl2的体积为896 mL(标准状况,SO2足量),最后得到纯净的SOCl2 7.14 g,则SOCl2的产率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,C的物质的量分数(C)和温度(T)或压强(P)关系如图,其中满足关系图的是( )
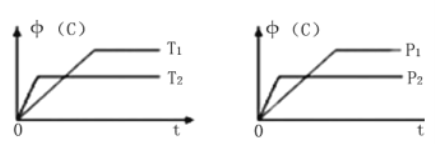
A. 3A(g)+B(s)![]() C(g)+D(g);△H<0
C(g)+D(g);△H<0
B. A(g)+B(s)![]() C(g)+D(g);△H<0
C(g)+D(g);△H<0
C. A(g)+B(s)![]() 2C(g)+D(g);△H>0
2C(g)+D(g);△H>0
D. A(g)+2B(s)![]() C(g)+3D(g);△H>0
C(g)+3D(g);△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要250 mL 0.5 moL/L的稀硫酸溶液,现用密度为1.84 g/mL,质量分数为98%的浓硫酸配制。请回答下列问题。
(1)下列仪器中,用不到的是__________。
A.250 mL容量瓶 B.500 mL容量瓶 C.50 mL量筒 D.10 mL量筒
(2)若要进行配制,除上述仪器外,尚缺少的仪器或用品是_______________________。
(3) 容量瓶上除有刻线和容量规格外还应标有温度,容量瓶在使用前必须进行的操作是:________。
(4)人们常将配制过程简述如下:①冷却;②洗涤烧杯中的液体;③量取;④溶解;⑤定容;⑥摇匀;⑦移液。其正确的操作顺序是________________________ (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含![]() 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品W g;
II.向样品中加人足量稀硫酸:
III.将II中产生的![]() ,用足量
,用足量![]() 溶液吸收;
溶液吸收;
IV.将III所得硫酸溶夜用氢氧化钠溶液滴定;
V.数据处理。
(1)![]() 是一种食品添加剂。写出
是一种食品添加剂。写出![]() 与稀
与稀![]() 反应的离子方程式:____________
反应的离子方程式:____________
(2)步骤中H2O2的作用是 __________________________
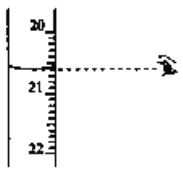
(3)步骤N中可选用的指示剂为__________。下图显示滴定终点时,滴定管(量程为25mL)读数为_______________。
(4)步骤IV中消耗![]() 溶液V mL,则1 kg样品中含
溶液V mL,则1 kg样品中含![]() 的质量是__________g(用含W、V的代数式表示)。
的质量是__________g(用含W、V的代数式表示)。
(5)此实验方案测得亚硫酸盐含量偏低,步骤II会产生该误差,请说明理由。(写出2条)_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com