
【题目】某实验小组利用下图所示装置在实验室欲制备乙酸乙酯。
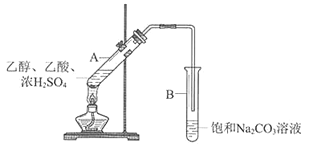
(1)B装置中,导管口略高于液面的目的是________________________
(2)为了改善反应过程中混合溶液变黑的现象,甲同学采用NaHSO4代替浓硫酸做催化剂(其他试剂及用量不变)来制备乙酸乙酯,NaHSO4可代替浓硫酸做催化剂的原因是__________________________________________________________
(3)下图是甲同学采用NaHSO4做催化剂,其他条件不变(其中乙酸用量为2 mL)不同质量的NaHSO4来制备乙酸乙酯的催化效果图,其中NaHSO4的质量为_______g时催化效果最好。

(4)乙同学实验时,在饱和NaCO3中滴加两滴酚酞,实验结束,取下试管B振荡,红色褪去。为探究褪色的原因,进行如下实验。
编号 | ① | ② | ③ |
实验 |
|
|
|
操作 | 充分振荡、静置 | 充分振荡、静置 | 充分振荡、静置、分液。取下层溶液,加入饱和Na2CO3溶液 |
现象 | 上层液体变薄,冒气泡,下层溶液红色褪去 | 上层液体不变薄,无气泡,下层溶液红色褪去 |
a试管①中产生气泡的原因是(用化学方程式解释)____________________________。
b对比实验①和②可得出的结论是___________________________________。
c针对实验②中现象,乙同学提出猜想:酚酞更易溶于乙酸乙酯。实验③中观察到__________________________________,证实乙的猜想正确。
【答案】防止倒吸 NaHSO4也可以电离出H+和SO42- 0.1 a. 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O b.下层溶液红色褪去的原因与乙酸无关 C. 溶液不变红或无明显现象
【解析】
(1)B装置中,导管口略高于液面的目的是防止倒吸。
(2)浓硫酸做催化剂,浓硫酸利用的浓硫酸的酸性和吸水性,采用NaHSO4代替浓硫酸做催化剂,是因为NaHSO4也可以电离出H+和SO42-。
(3)从图中乙酸乙酯的高度最高值读出;
(4)a、试管①中有末反应的醋酸,碳酸钠被反应消耗,酚酞红色褪去。
b、乙酸乙酯能将酚酞从碳酸钠溶液中萃取出去。
c、乙酸乙酯能将酚酞从水中萃取出去,在水层中再加碳酸钠,没有酚酞与之作用。
(1)B装置中,导管口略高于液面的目的是防止倒吸。
(2)浓硫酸具有脱水性,为了改善反应过程中混合溶液变黑的现象,用NaHSO4代替浓硫酸做催化剂(其他试剂及用量不变)来制备乙酸乙酯,浓硫酸作催化剂利用的浓硫酸的酸性和吸水性,采用NaHSO4代替浓硫酸做催化剂,是因为NaHSO4也可以电离出H+和SO42-。
(3)从图中乙酸乙酯的高度最高值读出:其中NaHSO4的质量为0.1g时催化效果最好。;
(4)a、试管①中有末反应的醋酸,产生气泡的原因是(用化学方程式解释)2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O,碳酸钠被反应消耗,酚酞红色褪去。
b、对比实验①和②可得出的结论是下层溶液红色褪去的原因与乙酸无关,乙酸乙酯能将酚酞从碳酸钠溶液中萃取出去。
c、针对实验②中现象,乙同学提出猜想:酚酞更易溶于乙酸乙酯。实验③中观察到溶液不变红或无明显现象,证实乙的猜想正确。乙酸乙酯能将酚酞从水中萃取出去,在水层中再加碳酸钠,没有酚酞与之作用。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:

则下列叙述错误的是( )
A.A气体是NH3,B气体是CO2
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法是否正确
(1) | (2) | (3) | (4) |
___ | ___ | ___ | ___ |
(1)22.4LO2中一定含有6.02×1023个氧分子
(2)将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L
(3)18gH2O在标准状况下的体积是22.4L
(4)在标准状况时,20mLNH3与60mLO2所含的分子个数比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列关于该有机物的性质说法错误的是( )
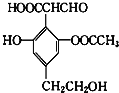
A. 1mol该物质可与4mol氢氧化钠溶液反应
B. 与NaHCO3溶液反应可以产生CO2气体
C. 该物质与H2反应,1mol该物质最多消耗3mol H2
D. 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O来制取NO,当有6.4gCu参加反应时,计算:
(1)用双线桥法标出电子转移的方向和数目;
(2)能生成多少升NO(标准状况下);
(3)使生成的Cu(NO3)2中Cu2+全部转化成沉淀,则至少需要质量分数为40%密度为1.42g/ml的NaOH溶液体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸氢钠粉末,pH增大,溶液漂白性增强
D. 光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W |
原子半径 | 160 | 143 | 70 | 66 |
主要化合价 |
|
|
|
|
下列叙述正确的是
A. X的电负性大于Y的电负性
B. W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键
C. Y的最高价氧化物对应的水化物能溶于稀硫酸和稀氨水
D. W的非金属性比Y强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72 L(标准状况下)时立即停止,则在这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)( )
A.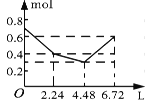 B.
B. C.
C.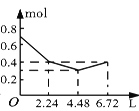 D.
D.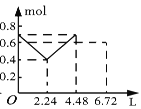
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
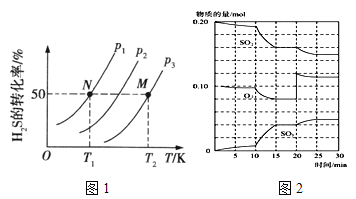
图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com