
����Ŀ���ҹ���ѧ�Һ�°����NaHCO3�ܽ�ȱ�NaCl��Na2CO3��NH4HCO3��NH4Cl��С�����ʣ�����CO2 + NH3 + H2O + NaCl = NaHCO3��+ NH4Cl�ķ�Ӧԭ���Ʊ������������ʵ���ҽ���ģ��ʵ�����������ʾ��ͼ��

�����������������( )
A.A������NH3��B������CO2
B.�ڢõ��ľ����Ƿ��ͷ۵���Ҫ�ɷ�
C.�ڢ����õ�����Ҫ�����������ձ���©����������
D.�ڢ�����������Ҫ�������ܽ⡢�������ᾧ
���𰸡�D
��������
A�����ڰ�����ˮ�е��ܽ�ȴ�����Ӧ����ˮ�м���������NaCl�γɱ�����Һ�������ڼ��Ի����п�������CO2�ܽ�ȣ���ͨ��CO2���壬�Ϳ�������CO2���ܽ�ȣ��γɸ����NaHCO3������Һ�����Ժ���γɳ���������������ˮ������ͨ��CO2�������������Ի����ܽ��С����Һ���γɵ�NaHCO3�٣��������ľ���Ҳ�٣�����A������NH3��B������CO2��ѡ��A��ȷ��
B���ڢõ��ľ�����NaHCO3���Ƿ��ͷ۵���Ҫ�ɷ֣�B��ȷ��
C���ڢ��˲��������õ�����Ҫ�����������ձ���©������������C��ȷ��
D���ڢ�����̼���������ȷֽ⣬��������Ҫ������ϴ�ӡ����ȣ�D����
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ������£�pH<7 ����Һ�����ԣ�pH=7 ����Һ�����ԣ�pH>7 ����Һ�Լ��ԡ��� FeCl3 ��ҺΪʵ�����̽�������������֮�䷴Ӧ�ĸ��Ӷ����ԡ�ʵ�����£�
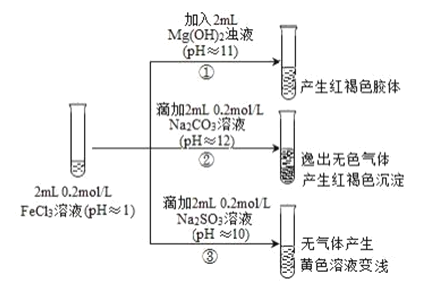
��֪���� Fe2+����Һ�м��� K3Fe(CN)6 ��Һ������ɫ������K3Fe(CN)6 = 3K++Fe(CN)6 3-
��1�����з�Ӧ�����ӷ���ʽ��______��
��2��д�����з�����Ӧ�Ļ�ѧ����ʽ______��
��3���������е�ʵ������ͬѧ�������²⣬��������ʵ�飺
���飺ȡ���з�Ӧ����Һ����������ϡ�����ữ���ٵμ� BaCl2 ��Һ��������ɫ�������ó����ۣ�FeCl3 �� Na2SO3 ������������ԭ��Ӧ������SO32-������������______�������ӵĻ�ѧʽ����
���飺��Ϊ�����ʵ�鲻�Ͻ���������Ʋ�����ʵ�飬֤ʵ�˼���Ľ�������ȷ�ġ���ʵ�鷽����ȡ���з�Ӧ�����Һ������ K3Fe(CN)6 ��Һ������______������ɫ�����Ļ�ѧʽ�������в�����Ԫ�أ���˵�������� Fe2+����д�� FeCl3 �� Na2SO3 ��Һ��Ӧ�����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������������ˮ��pH��5.0~6.0֮�䣬ͨ���������Fe(OH)3������Fe(OH)3�������ԣ�������������������������о���ˮ�����á��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ(��Ʋ��)�����㣬�����˸�ѡ���������á�ij����С���õ縡ѡ���۷�������ˮ�����װ��ʾ��ͼ����ͼ��ʾ��
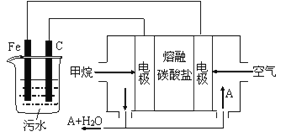
��1��ʵ��ʱ����ˮ������Ũ�Ƚ�С�����������ϲ�����������ʻ�������ʹ�������γɸ�������ʱ��Ӧ����ˮ�м���������__________��
a��H2SO4 b��BaSO4 c��Na2SO4 d��NaOH
��2���������������������缫��Ӧ���缫��Ӧʽ�ֱ���
��.___________________�� ��._________________��
��3���缫��Ӧ��͢�������ﷴӦ�õ�Fe(OH)3���������ӷ���ʽ��__________________��
��4����ȼ�ϵ����������̼����Ϊ����ʣ�CH4Ϊȼ�ϣ�����Ϊ��������ϡ�������������缫��
�ٸ����ĵ缫��Ӧ��____________________��
��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ�����в���A���ʲμ�ѭ��������ͼ����A���ʵĻ�ѧʽ��_________________��
��5��ʵ������У���������������44.8 L����״�������壬��������ȼ�ϵ������CH4����״����____L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ������Ȼ����ͨ������������λ��ʵ���ʽ���ڣ��䵥�ʺͻ������ڹ�ũҵ������������Ҫ�����á�
��1����Ԫ�������ڱ��е�λ��Ϊ___________���������̬�⻯��ĵ���ʽΪ_________��
��2���ڹ�ҵ��SO2���������Ʊ�H2SO4��
��֪SO2(g)��![]() O2(g)��H2O(g)=H2SO4(l) ��H1=��272.5kJ��mol��1
O2(g)��H2O(g)=H2SO4(l) ��H1=��272.5kJ��mol��1
H2O(g)=H2O(l) ��H2=��44kJ��mol��1
SO3(g)��H2O(l)=H2SO4(l) ��H3=��130kJ��mol��1
��2SO2(g)��O2(g)=2SO3(g) ��H=_____________kJ��mol��1
(3)ij��ȤС��ͬѧ̽��SO2�Ļ�ԭ�ԣ�ʹ�õ�ҩƷ��װ����ͼ��ʾ:

Aƿ�з�����Ӧ�����ӷ���ʽΪ_______________________��Bƿ�г��ֵ�����Ϊ________����Ҫ֤��A��B�ķ�Ӧ��SO2�����ֻ�ԭ�Ա�����ΪSO42�������Բ�ȡ�IJ�����������_______________________________________��
��4������������ŷŵ������л���ɿ�����Ⱦ�����³�ѹ������ͼ��ʾ���������Լ�������SO2�ĺ��������й��ڸô�������������ȷ����__________(�����)��

A. aΪ��Դ������
B. Pt�缫���Ϸ���������Ӧ
C.����·�е���ת��0.5molʱ�����봫������SO2Ϊ11.2L
D.�����ĵ缫��Ӧ��2HSO3��+2H+-2e��=S2O42��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3�������Ϊ1 L�ĺ����ܱ������з�����Ӧ��SO2(g)��2NO(g)![]() 2NO2(g)��S(s)���ı�����I�ķ�Ӧ�¶���ƽ��ʱc( NO2)���¶ȵĹ�ϵ����ͼ��ʾ������˵����ȷ����
2NO2(g)��S(s)���ı�����I�ķ�Ӧ�¶���ƽ��ʱc( NO2)���¶ȵĹ�ϵ����ͼ��ʾ������˵����ȷ����


A. �÷�Ӧ����H<0
B. T1ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ![]()
C. ������������������T1ʱ�ﵽƽ�⣬��ѹǿ֮��С��1:2
D. ��T2<T1���ﵽƽ��ʱ����������NO���������С��40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���ܱ��������м���һ�����ɻ����ĸ���(��ȿɺ���)�������ֳ������֣���������1 mol N2���Ҳ����CO��CO2�Ļ�����干8 gʱ�����崦����ͼλ��(���������¶���ͬ)������˵����ȷ����
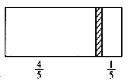
A. �Ҳ�CO��CO2������֮��Ϊ1��3
B. �Ҳ������ܶ�����ͬ�����������ܶȵ�18��
C. �Ҳ�CO������Ϊ1.75 g
D. �����崦�ھ����Ҷ�1/6���������������䣬��ǰ������ѹǿ֮��Ϊ25��24
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����»�ѧ��Ӧ����ʽ����������ӷ�Ӧ����д���ӷ�Ӧ����ʽ��
��1������ͨ��ʯ��������ȡƯ�ۣ�_________________________________
��2��Ư����Ч:_________________________________
��3�����͵�̼������Һ��ͨ�������̼��_________________________________
��4�����������������̼��Ӧ��_________________________________
��5�����������ֽ⣺_________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�����͡���Ч�������ɫˮ����������ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
��1���ɷ��Ʊ��������Ƶ���Ҫ��ӦΪ��2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2�����÷�Ӧ��Na2O2 ��___________��������������ԭ����
��2��ʪ���Ʊ�������صķ�Ӧ��ϵ������������Fe(OH)3��ClO����OH����FeO42-��Cl����H2O��
�ټ��������£��������ͻ�ԭ�������ʵ����ı�Ϊ3:2������Ӧ��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��__________________��
������Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ__________mol��
����֪��2Fe3����2I��=2Fe2����I2��2Fe2����Br2=2Fe3����2Br����
��1������1 mol FeI2��2 mol FeBr2����Һ��ͨ��2 mol Cl2����ʱ��������������______��
��2������a mol FeI2��b mol FeBr2����Һ��ͨ��c mol Cl2����I����Fe2����Br����ȫ������ʱ��c=__________���ú�a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������ͼ��ʾװ����ʵ�������Ʊ�����������
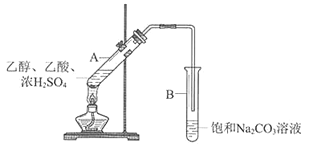
��1��Bװ���У����ܿ��Ը���Һ���Ŀ����________________________
��2��Ϊ�˸��Ʒ�Ӧ�����л����Һ��ڵ�����ͬѧ����NaHSO4����Ũ�����������������Լ����������䣩���Ʊ�����������NaHSO4�ɴ���Ũ������������ԭ����__________________________________________________________
��3����ͼ�Ǽ�ͬѧ����NaHSO4�������������������䣨������������Ϊ2 mL����ͬ������NaHSO4���Ʊ����������Ĵ�Ч��ͼ������NaHSO4������Ϊ_______gʱ��Ч����á�

��4����ͬѧʵ��ʱ,�ڱ���NaCO3�еμ����η�̪��ʵ�������ȡ���Թ�B����ɫ��ȥ��Ϊ̽����ɫ��ԭ��������ʵ�顣
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | ��������� | ��������� | ��������á���Һ��ȡ�²���Һ�����뱥��Na2CO3��Һ |
���� | �ϲ�Һ��䱡��ð���ݣ��²���Һ��ɫ��ȥ | �ϲ�Һ�岻�䱡�������ݣ��²���Һ��ɫ��ȥ |
a�Թܢ��в������ݵ�ԭ���ǣ��û�ѧ����ʽ���ͣ�____________________________��
b�Ա�ʵ��ٺ͢ڿɵó��Ľ�����___________________________________��
c���ʵ�����������ͬѧ������룺��̪������������������ʵ����й۲쵽__________________________________��֤ʵ�ҵIJ�����ȷ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com