
【题目】通常情况下,pH<7 的溶液显酸性,pH=7 的溶液显中性,pH>7 的溶液显碱性。以 FeCl3 溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
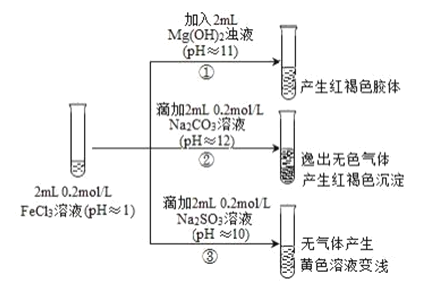
已知:含 Fe2+的溶液中加入 K3Fe(CN)6 溶液生成蓝色沉淀。K3Fe(CN)6 = 3K++Fe(CN)6 3-
(1)①中反应的离子方程式是______。
(2)写出②中发生反应的化学方程式______。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加 BaCl2 溶液,产生白色沉淀。得出结论:FeCl3 与 Na2SO3 发生了氧化还原反应,其中SO32-被氧化生成了______(填离子的化学式)。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是取③中反应后的溶液,加入 K3Fe(CN)6 溶液,生成______(填蓝色沉淀的化学式,沉淀中不含钾元素),说明生成了 Fe2+。请写出 FeCl3 与 Na2SO3 溶液反应的离子方程式:______。
【答案】3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+ 2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+6NaCl+3CO2↑ SO42- Fe3[Fe(CN)6]2 2Fe3++ SO32-+ H2O= 2Fe2++ SO42-+2H+
【解析】
(1) 实验①中反应为氯化铁溶液和Mg(OH)2浊液反应生成红褐色的Fe(OH)3胶体,其离子方程式为::3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+,
故答案为:3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+;
(2) 实验②为pH=1的FeCl3溶液显酸性, pH=12的Na2CO3溶液显碱性,二者等物质的量混合后,三价铁离子与碳酸根离子都会发生水解,且二者相互促进水解,生成氢氧化铁沉淀和二氧化碳,其反应离子方程式为:2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+6NaCl+3CO2↑,
故答案为:2FeCl3+3Na2CO3+3H2O=2 Fe(OH)3↓+6NaCl+3CO2↑;
(3)甲组:由实验现象滴入稀盐酸酸化,再滴加 BaCl2 溶液,产生白色沉淀可知,溶液中经过反应产生SO42-,则Fe3+被还原为Fe2+,化合价降低,故SO32-被Fe3+氧化为SO42-,其离子反应方程式为:2Fe3++ SO32-+ H2O= 2Fe2++ SO42-+2H+,
答案为:SO42-;
乙组:因SO32-可能被空气氧化,若要证实SO32-与Fe3+发生氧化还原反应,可通过验证是否有Fe2+生成,根据题干信息可知,可选用K3Fe(CN)6溶液进行检验,故实验方案为:取③中反应后的溶液,加入K3Fe(CN)6溶液,发生反应生成蓝色沉淀,说明生成了Fe2+,发生的离子反应方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;根据甲组实验分析,FeCl3 与 Na2SO3 溶液反应的离子方程式. 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+
答案为:Fe3[Fe(CN)6]2;2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。


科目:高中化学 来源: 题型:
【题目】已知:2Cu(IO3)2+24KI+12H2SO4=2CuI![]() (碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
(碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
A.Cu(IO3)2作氧化剂,Cu(IO3)2中只有碘元素被还原
B.CuI既是氧化产物又是还原产物
C.每生成1mol CuI,有11mol KI发生氧化反应
D.每转移1.1mol电子,有0.2mol IO3-被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 28g乙烯所含共用电子对数目为2NA
B. 14g乙烯、丙烯、丁烯的混合气体中,所含原子数为3NA
C. 标准状况下,11.2L氟化氢所含分子数为0.5NA
D. 1.5g甲基所含电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为 H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动 物和真菌体中。下列有关判断不正确的是
A.草酸的摩尔质量是 90 g/mol
B.草酸中碳元素的质量分数为 13.3%
C.1 mol 草酸中约含有 6.02×1023 个分子
D.1 mol 草酸在标准状况下的体积约为 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态硼原子的价电子轨道表达式是_______________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________。
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的________。
(3)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______,写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH![]() 的键角是________,立体构型为___________。
的键角是________,立体构型为___________。
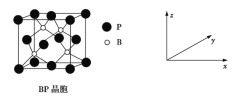
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______;已知晶胞边长为458 pm,则磷化硼晶体的密度是____g·cm-3(列式并计算,结果保留两位有效数字,已知4.583=96.07)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素 C(又名抗坏血酸,分子式为 C6H8O6)具有较强的还原性,放置在空气中易被氧化,其质量分数可通过在弱酸性溶液中用已知物质的量浓度的 I2 溶液进行测定。该反应 的化学方程式如下:C6H8O6+ I2 = C6H6O6 +2HI。现欲测定某样品中维生素 C 的质量分 数,具体的步骤及测得的数据如下:取10mL6mol/LCH3COOH(提供酸性环境),加入100 mL 蒸馏水,将溶液加热煮沸后放置冷却。精确称取 0.2000g 样品,溶解于上述冷却的 溶液中,立即用物质的量浓度为 0.05000 mol/L 的 I2 溶液进行反应,刚好完全反应时共消耗21.00 mL I2 溶液。
(1)CH3COOH 稀溶液要先经煮沸、冷却后才能使用,煮沸的是为了赶走溶液在溶液中的_____(填物质的化学式)
(2)样品中维生素 C 的质量分数为______。计算过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述错误的是
A. 56 g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
B. 标准状况下22.4L CH4和C2H4的混合气体所含氢原子数为4NA
C. 常温常压下,3.4gNH3中含N—H键数目为0.6NA
D. 1mol 固体NaHSO4含有的阴阳离子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。

(1)写出化学式:A___________B____________J_____________。
(2)反应③中每生成1molF,转移电子的数目为:___________。
(3)反应④的化学方程式为:________________________________________________。
(4)离子方程式分别为:反应②__________________________________________;
⑤__________________________________________________________。
(5)反应①中,每1.00gC与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:

则下列叙述错误的是( )
A.A气体是NH3,B气体是CO2
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com