
【题目】某有机物的结构简式如图所示,下列关于该有机物的性质说法错误的是( )
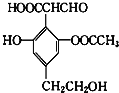
A. 1mol该物质可与4mol氢氧化钠溶液反应
B. 与NaHCO3溶液反应可以产生CO2气体
C. 该物质与H2反应,1mol该物质最多消耗3mol H2
D. 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在,其单质和化合物在工农业生产中有着重要的作用。
(1)硫元素在周期表中的位置为___________,其最简单气态氢化物的电子式为_________。
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+![]() O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=_____________kJ·mol-1
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:

A瓶中发生反应的离子方程式为_______________________。B瓶中出现的现象为________。若要证明A、B的反应中SO2均显现还原性被氧化为SO42—,可以采取的操作和现象是_______________________________________。
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是__________(填序号)。

A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是___________(填氧化剂、还原剂)
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:__________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为__________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是______。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c=__________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出化学方程式
(1)硫在氧气中燃烧的化学方程式____
(2)碳粉和氧气的化学反应方程式____
(3)水蒸气与灼热的炭发生氧化还原反应的化学方程式____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素的基态价电子排布式为_____________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______________,提供孤电子对的成键原子是_____________。
③氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是__________________;氨是_________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______________键形成的晶体。
(4)某镍白铜合金的立方晶胞结构如图所示。
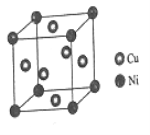
①晶胞中铜原子与镍原子的数量比为___________。
②若合金的密度为dg/cm3,晶胞边长a=______________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于化合反应,又属于氧化还原反应的是( )
A.Fe+2HCl=H2↑+FeCl2B.2FeCl2+Cl2=2FeCl3
C.CaO+H2O=Ca(OH)2D.2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图所示装置在实验室欲制备乙酸乙酯。
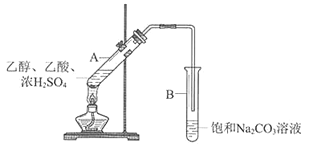
(1)B装置中,导管口略高于液面的目的是________________________
(2)为了改善反应过程中混合溶液变黑的现象,甲同学采用NaHSO4代替浓硫酸做催化剂(其他试剂及用量不变)来制备乙酸乙酯,NaHSO4可代替浓硫酸做催化剂的原因是__________________________________________________________
(3)下图是甲同学采用NaHSO4做催化剂,其他条件不变(其中乙酸用量为2 mL)不同质量的NaHSO4来制备乙酸乙酯的催化效果图,其中NaHSO4的质量为_______g时催化效果最好。

(4)乙同学实验时,在饱和NaCO3中滴加两滴酚酞,实验结束,取下试管B振荡,红色褪去。为探究褪色的原因,进行如下实验。
编号 | ① | ② | ③ |
实验 |
|
|
|
操作 | 充分振荡、静置 | 充分振荡、静置 | 充分振荡、静置、分液。取下层溶液,加入饱和Na2CO3溶液 |
现象 | 上层液体变薄,冒气泡,下层溶液红色褪去 | 上层液体不变薄,无气泡,下层溶液红色褪去 |
a试管①中产生气泡的原因是(用化学方程式解释)____________________________。
b对比实验①和②可得出的结论是___________________________________。
c针对实验②中现象,乙同学提出猜想:酚酞更易溶于乙酸乙酯。实验③中观察到__________________________________,证实乙的猜想正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,在农药、制药行业中用途广泛。实验室合成原理为:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:

已知:①SOCl2沸点为78.8℃,SCl2 的沸点为50℃,且两种液体可互溶。
②SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的有气体产生。
(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是:⑥→__________→①,②←______________(某些仪器可以多次使用)。
(2)仪器a的名称是________,仪器b的作用是____________。
(3)本实验中制Cl2的离子方程式为___________________,本实验中制SO2的化学方程式为______________________,SOCl2与水反应的化学方程式为___________。
(4)实验结束后,从三颈烧瓶分离出SOCl2的实验操作名称是_________________。若反应中消耗Cl2的体积为896 mL(标准状况,SO2足量),最后得到纯净的SOCl2 7.14 g,则SOCl2的产率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按指定要求完成下列问题。
(1)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被水还原的BrF3的物质的量是___。
(2)已知砒霜As2O3与Zn可发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___。
②若生成0.2molAsH3,则转移的电子数为___。
(3)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有以下两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___。
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两种方法中消耗的还原剂质量之比是___。
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为Cl-,则相同质量的ClO2是Cl2消毒效率的___倍(消毒效率:等质量两种物质所转移电子的物质的量之比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com