
【题目】请按指定要求完成下列问题。
(1)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被水还原的BrF3的物质的量是___。
(2)已知砒霜As2O3与Zn可发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___。
②若生成0.2molAsH3,则转移的电子数为___。
(3)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有以下两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___。
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两种方法中消耗的还原剂质量之比是___。
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为Cl-,则相同质量的ClO2是Cl2消毒效率的___倍(消毒效率:等质量两种物质所转移电子的物质的量之比)。
【答案】![]() mol
mol 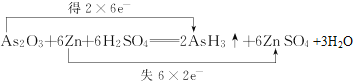 1.2NA 1:1 73:34 2.63
1.2NA 1:1 73:34 2.63
【解析】
(1)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,有5molH2O参加反应,失去电子4mol,在BrF3中,1molBrF3得到3mol电子,则被水还原的BrF3的物质的量是![]() mol。答案为:
mol。答案为:![]() mol
mol
(2)①反应As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O中,As的化合价由+3价降至-3价,Zn的化合价由0价升至+2价,用双线桥法标出电子转移的方向和数目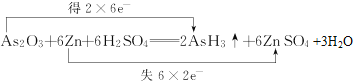 。
。
答案为:
②生成2molAsH3转移12mol电子,若生成0.2molAsH3,则转移的电子数为1.2mol ×NA=1.2NA。答案:1.2NA
(3)①方法一中氧化剂NaClO3与还原剂HCl(4molHCl参与反应,只有2mol表现出还原性,被氧化)的物质的量之比为2:2=1:1。答案为:1:1
②若两种方法制备得到相同条件下相同体积的ClO2气体,假设为2mol ClO2,则前者消耗还原剂HCl 2mol,后者消耗还原剂H2O2 1mol,质量之比是(2mol×36.5g/mol):(1mol×34g/mol)=73:34。答案为73:34
③设Cl2与ClO2的质量均为mg
Cl2 ~ 2Cl- ~ 2e- ClO2 ~ Cl- ~ 5e-
71g 2mol 67.5g 5mol
mg ![]() mg
mg ![]()
则相同质量的ClO2是Cl2消毒效率的倍数为: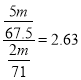
答案为:2.63。


科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列关于该有机物的性质说法错误的是( )
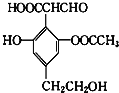
A. 1mol该物质可与4mol氢氧化钠溶液反应
B. 与NaHCO3溶液反应可以产生CO2气体
C. 该物质与H2反应,1mol该物质最多消耗3mol H2
D. 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72 L(标准状况下)时立即停止,则在这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)( )
A.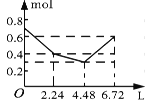 B.
B. C.
C.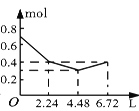 D.
D.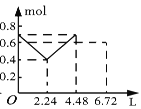
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
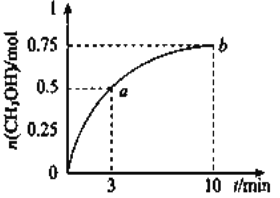
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和铁的氧化物等杂质)为原料制备铝与硫酸亚铁,工艺流程如图所示:请回答下列问题:
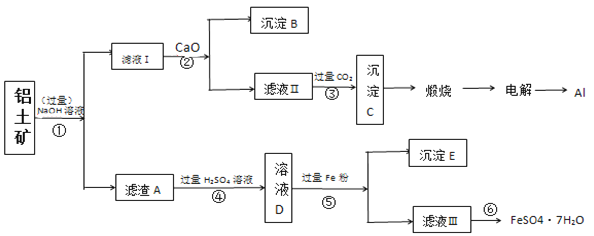
(1)步骤①中提高碱浸速率的方法_______。
(2)滤液Ⅰ中主要的阴离子是______,沉淀B的化学式____,步骤③的离子方程式:____。
(3)步骤⑤加入过量的铁粉的目的___(用离子方程式解释)
(4)检验滤液Ⅲ中的金属阳离子的方法是:_____。
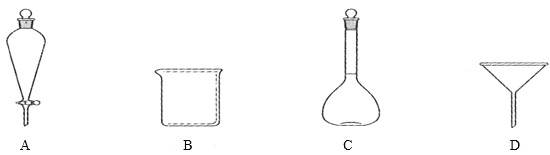
(5)滤液Ⅲ经过________,_______,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有___(填标号)。
(6)利用上述工艺流程测定铝土矿中铁元素的质量分数,取10g样品,最终得到5.56g的FeSO4·7H2O晶体,该铝土矿中铁元素的质量分数_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
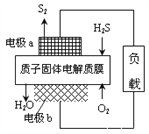
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
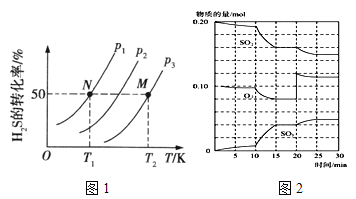
图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有H+,Mg2+,Na+,Ba2+,Fe3+,Cl﹣,CO32﹣,SO42﹣等离子,取该溶液进行以下实验
a.用PH试纸检验,表明溶液呈强酸性。
b.取部分溶液逐渐滴加入NaOH溶液,使溶液从酸性逐渐变成碱性,整个滴加过程中,溶液均无沉淀生成。
c.取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成。
(1)根据上述事实确定:该溶液中肯定存在的离子有____________;肯定不存在的离子有____________;可能存在的离子有____________。
(2)写出以下反应的离子方程式:
①氧化镁溶于盐酸____________。
②碳酸氢钠溶液与氢氧化钠溶液混合____________。
③氢氧化钡与稀硫酸混合____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com