
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,在农药、制药行业中用途广泛。实验室合成原理为:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:

已知:①SOCl2沸点为78.8℃,SCl2 的沸点为50℃,且两种液体可互溶。
②SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的有气体产生。
(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是:⑥→__________→①,②←______________(某些仪器可以多次使用)。
(2)仪器a的名称是________,仪器b的作用是____________。
(3)本实验中制Cl2的离子方程式为___________________,本实验中制SO2的化学方程式为______________________,SOCl2与水反应的化学方程式为___________。
(4)实验结束后,从三颈烧瓶分离出SOCl2的实验操作名称是_________________。若反应中消耗Cl2的体积为896 mL(标准状况,SO2足量),最后得到纯净的SOCl2 7.14 g,则SOCl2的产率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按指定要求完成下列问题。
(1)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被水还原的BrF3的物质的量是___。
(2)已知砒霜As2O3与Zn可发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___。
②若生成0.2molAsH3,则转移的电子数为___。
(3)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有以下两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___。
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两种方法中消耗的还原剂质量之比是___。
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为Cl-,则相同质量的ClO2是Cl2消毒效率的___倍(消毒效率:等质量两种物质所转移电子的物质的量之比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价电子(外围电子)排布式为______________________________。
(2)硝酸钾中![]() 的空间构型为________,写出与
的空间构型为________,写出与![]() 互为等电子体的一种非极性分子化学式__________________________________________________________________。
互为等电子体的一种非极性分子化学式__________________________________________________________________。
(3)6氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有____________。
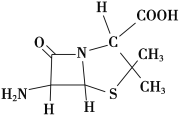
(4)下列说法正确的有________(填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(CH2CH2)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)===SiO2(s)中,每生成60 g SiO2放出的能量为(2c-a-b) kJ
化学键 | Si—Si | O===O | Si—O |
键能(kJ·mol-1) | a | b | c |
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式______________________________________。
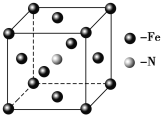 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含![]() 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品W g;
II.向样品中加人足量稀硫酸:
III.将II中产生的![]() ,用足量
,用足量![]() 溶液吸收;
溶液吸收;
IV.将III所得硫酸溶夜用氢氧化钠溶液滴定;
V.数据处理。
(1)![]() 是一种食品添加剂。写出
是一种食品添加剂。写出![]() 与稀
与稀![]() 反应的离子方程式:____________
反应的离子方程式:____________
(2)步骤中H2O2的作用是 __________________________
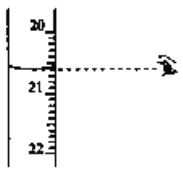
(3)步骤N中可选用的指示剂为__________。下图显示滴定终点时,滴定管(量程为25mL)读数为_______________。
(4)步骤IV中消耗![]() 溶液V mL,则1 kg样品中含
溶液V mL,则1 kg样品中含![]() 的质量是__________g(用含W、V的代数式表示)。
的质量是__________g(用含W、V的代数式表示)。
(5)此实验方案测得亚硫酸盐含量偏低,步骤II会产生该误差,请说明理由。(写出2条)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是()
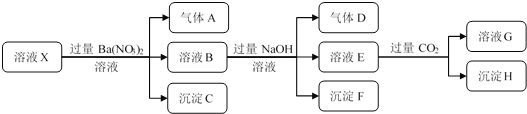
A. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为112ml(标况),则X中c(Fe2+)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去)。A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素。
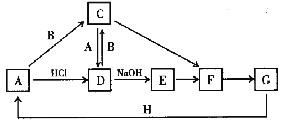
(1) B 的电子式为____________。
(2) 检验D中金属阳离子的实验方案是____________。
(3) 金属H 既能与强酸反应又能与强碱反应,其与NaOH 溶液反应的离子方程式为____________。
(4) E 在空气中转化成F 的化学方程式为____________。
(5) 理论上G 与H 反应生成1mol 固体A 放出428kJ 热量,G 与H 反应的热化学方程式为____________。
(6) 单质A 在氧气中的燃烧产物X 可用于去除地下水中的![]() 具有放射性)。在酸性条件下,X 将TcO4-转化为难溶于水的TcO2,同时得到F,该反应的离子方程式为____________。
具有放射性)。在酸性条件下,X 将TcO4-转化为难溶于水的TcO2,同时得到F,该反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.铁粉与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸镁溶于醋酸的反应:MgCO3+2H+=Ca2++CO2↑+H2O
C.在澄清石灰水中通入少量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为 0.1mol/L、体积均为 100mL 的两种一元酸HX、HY溶液,下列叙述不正确的是()
A. 若此时 HY 溶液的 pH=3,则 HY 是弱酸
B. 若分别加入 0.01molNaOH 固体,则酸碱恰好完全中和
C. 若分别加入 0.01molNaOH 固体,则所得溶液的pH 均为 7
D. 若此时 HX 溶液的 pH=1,则由水电离出的c(H+) =1×10-13 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com