
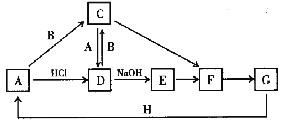
【题目】A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去)。A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素。
(1) B 的电子式为____________。
(2) 检验D中金属阳离子的实验方案是____________。
(3) 金属H 既能与强酸反应又能与强碱反应,其与NaOH 溶液反应的离子方程式为____________。
(4) E 在空气中转化成F 的化学方程式为____________。
(5) 理论上G 与H 反应生成1mol 固体A 放出428kJ 热量,G 与H 反应的热化学方程式为____________。
(6) 单质A 在氧气中的燃烧产物X 可用于去除地下水中的![]() 具有放射性)。在酸性条件下,X 将TcO4-转化为难溶于水的TcO2,同时得到F,该反应的离子方程式为____________。
具有放射性)。在酸性条件下,X 将TcO4-转化为难溶于水的TcO2,同时得到F,该反应的离子方程式为____________。
【答案】![]() 取少量D溶液于试管中,先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+) 2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑ 4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)3 2Al(s) + Fe2O3(s) = 2Fe(s) + Al2O3(s) ΔH = -856 kJ·mol-1 3Fe3O4+ TcO4-+ H++13H2O = 9Fe(OH)3+ TcO2
取少量D溶液于试管中,先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+) 2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑ 4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)3 2Al(s) + Fe2O3(s) = 2Fe(s) + Al2O3(s) ΔH = -856 kJ·mol-1 3Fe3O4+ TcO4-+ H++13H2O = 9Fe(OH)3+ TcO2
【解析】
通常状况下B为黄绿色气体,则B为Cl2,A是常见的金属单质,且A与盐酸反应生成D,D又与氯气反应生成C,A也能与氯气反应生成C,且A与C反应生成D,则A应为Fe,D为FeCl2,C为FeCl3,C、D、E、F、G物种化合物含有同一种元素,且G为红棕色固体,D与氢氧化钠反应生成E为Fe(OH)2,E氧化得F为Fe(OH)3,F受执分解得G为Fe2O3,H是常见的金属单质,工业上常用电解法冶炼H,金属H既能与强酸反应又能与强碱反应,则H应为Al,氧化铁与铝发生铝热反应得铁,符合各物质的转化关系,据此答题。
(1)根据上面的分析可知,B为Cl2,B的电子式为![]() ,
,
故答案为:![]() ;
;
(2)D为FeCl2,检验D中金属阳离子的实验方案是先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+),
故答案为:先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+);
(3)金属H既能与强酸反应又能与强碱反应,其与NaOH溶液反应的离子方程式为 2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)E为Fe(OH)2,E在空气中转化成F的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(5)G为Fe2O3,理论上G与H反应生成1mol固体Fe放出428kJ热量,则生成2mol铁应放出856kJ热量,G与H反应的热化学方程式为2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-856kJmol-1,
故答案为:2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-856kJmol-1;
(6)单质铁在氧气中的燃烧产物X应为Fe3O4,在酸性条件下,Fe3O4将TcO4--转化为难溶于水的TcO2,同时得到Fe(OH)3,该反应的离子方程式为3Fe3O4+TcO4-+H++13H2O═9Fe(OH)3+TcO2,
故答案为:3Fe3O4+TcO4-+H++13H2O═9Fe(OH)3+TcO2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】往含0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72 L(标准状况下)时立即停止,则在这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)( )
A.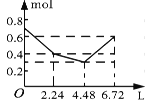 B.
B. C.
C.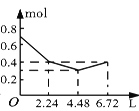 D.
D.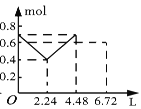
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
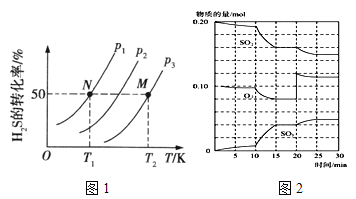
图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)147gH2SO4的物质的量是_______;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_____,_____元素化合价降低;______作还原剂,_____发生还原反应。
(4)钠在空气中燃烧的化学方程式:_____,1mol钠完全燃烧转移电子的个数为______(阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O,试完成下面的问题:
CuSO4+A↑+2H2O,试完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______(用字母代号填写)
a.酸 b. 碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)该反应中被氧化的元素是_________________,参加反应的氧化剂与还原剂的物质的量之比为______。
(3)写出该反应的化学方程式并用双线桥标出电子转移的方向和数目:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有H+,Mg2+,Na+,Ba2+,Fe3+,Cl﹣,CO32﹣,SO42﹣等离子,取该溶液进行以下实验
a.用PH试纸检验,表明溶液呈强酸性。
b.取部分溶液逐渐滴加入NaOH溶液,使溶液从酸性逐渐变成碱性,整个滴加过程中,溶液均无沉淀生成。
c.取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成。
(1)根据上述事实确定:该溶液中肯定存在的离子有____________;肯定不存在的离子有____________;可能存在的离子有____________。
(2)写出以下反应的离子方程式:
①氧化镁溶于盐酸____________。
②碳酸氢钠溶液与氢氧化钠溶液混合____________。
③氢氧化钡与稀硫酸混合____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
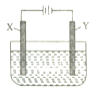
【题目】(1)电解原理具有广泛应用,如图为在铁上镀铜的简易装置示意图,则X极材料为___, 电极反应式为___;电解质溶液为___。
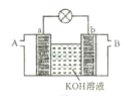
(2)燃料电池是一种将燃料所具有的化学能直接转化成电能的装置。
①以多孔铂为电极,如图装置中 A、B 口分别通入CH3 CH2OH和O2构成燃料电池模型,该电池负极的电极反应式为___。
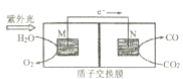
②科学家研究了转化温室气体的方法,利用如图所示装置可以将CO2 转化为气体燃料CO,该电池正极的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com