
【题目】(1)147gH2SO4的物质的量是_______;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_____,_____元素化合价降低;______作还原剂,_____发生还原反应。
(4)钠在空气中燃烧的化学方程式:_____,1mol钠完全燃烧转移电子的个数为______(阿伏伽德罗常数为NA)。
【答案】1.5mol 4 碘(或I) 氧化 铁(或Fe) KI FeCl3 2Na+O2![]() Na2O2 NA
Na2O2 NA
【解析】
(1)根据n=![]() 计算硫酸的物质的量;
计算硫酸的物质的量;
(2)根据反应过程中电子转移的物质的量等于元素化合价升降数目计算;
(3)根据氧化还原反应的规律判断分析;
(4)钠与氧气在点燃时反应产生过氧化钠,根据元素化合价升降数目判断电子转移数目。
(1)n(H2SO4)=![]() =
=![]() =1.5mol;
=1.5mol;
(2)在反应中O元素的化合价部分由-2价升高到0价,每生成1molO2,元素化合价升高4价,所以生成1molO2分子,转移电子数为4mol;
(3)在反应2FeCl3+2KI=2FeCl2+2KCl+I2中,I元素化合价由KI中的-1价变为反应后I2的0价,化合价升高,I元素失电子,被氧化,所以KI为还原剂;Fe元素的化合价由反应前FeCl3中的+3价变为反应后FeCl2中的+2价,Fe元素的化合价降低,得电子,被还原,所以FeCl3作氧化剂,被还原;
(4)钠在空气中燃烧生成过氧化钠,反应的化学方程式为:2Na +O2![]() Na2O2,在该反应中,Na元素的化合价由反应前Na单质的0价变为反应后Na2O2中的+1价,化合价升高,失去电子。由于Na元素化合价升高1价,所以1mol钠完全燃烧转移1mol电子,转移电子数目为NA。
Na2O2,在该反应中,Na元素的化合价由反应前Na单质的0价变为反应后Na2O2中的+1价,化合价升高,失去电子。由于Na元素化合价升高1价,所以1mol钠完全燃烧转移1mol电子,转移电子数目为NA。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】实验:①将![]() 溶液和
溶液和![]() 溶液等体积混合得到浊液;②取少量①中浊液,滴加
溶液等体积混合得到浊液;②取少量①中浊液,滴加![]() 溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加
溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加![]() 溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
A. 将①中浊液过滤,所得滤液中含少量![]()
B. ①中浊液存在平衡:![]()
C. ②中沉淀颜色变化说明![]() 转化为
转化为![]()
D. ③可以证明![]() ,比
,比![]() 更难溶
更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价电子(外围电子)排布式为______________________________。
(2)硝酸钾中![]() 的空间构型为________,写出与
的空间构型为________,写出与![]() 互为等电子体的一种非极性分子化学式__________________________________________________________________。
互为等电子体的一种非极性分子化学式__________________________________________________________________。
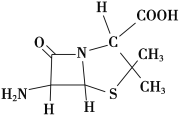
(3)6氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有____________。
(4)下列说法正确的有________(填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(CH2CH2)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)===SiO2(s)中,每生成60 g SiO2放出的能量为(2c-a-b) kJ
化学键 | Si—Si | O===O | Si—O |
键能(kJ·mol-1) | a | b | c |
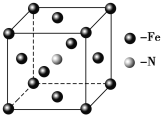
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式______________________________________。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是()
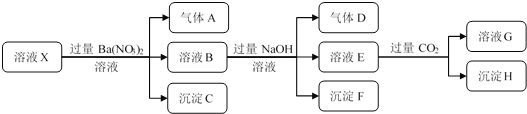
A. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为112ml(标况),则X中c(Fe2+)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去)。A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素。
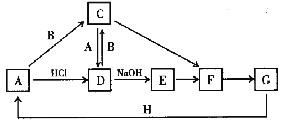
(1) B 的电子式为____________。
(2) 检验D中金属阳离子的实验方案是____________。
(3) 金属H 既能与强酸反应又能与强碱反应,其与NaOH 溶液反应的离子方程式为____________。
(4) E 在空气中转化成F 的化学方程式为____________。
(5) 理论上G 与H 反应生成1mol 固体A 放出428kJ 热量,G 与H 反应的热化学方程式为____________。
(6) 单质A 在氧气中的燃烧产物X 可用于去除地下水中的![]() 具有放射性)。在酸性条件下,X 将TcO4-转化为难溶于水的TcO2,同时得到F,该反应的离子方程式为____________。
具有放射性)。在酸性条件下,X 将TcO4-转化为难溶于水的TcO2,同时得到F,该反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.分别取一定质量的甲烷、乙炔、苯、己烯、甲苯,完全燃烧后都生成m mol CO2和n mol H2O。(1)若m=n,该烃是____(2)若m=2n,该烃是____(3)若4m=7n,该烃是____
II.蒽(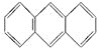 )与苯炔(|
)与苯炔(|![]() )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示:
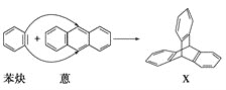
(1)蒽与X都属于(填字母)__________a.环烃 b.烃 c.不饱和烃
(2)苯炔不具有的性质是(填字母)_______
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(3)下列属于苯的同系物的是(填字母,下同)____

(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.铁粉与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸镁溶于醋酸的反应:MgCO3+2H+=Ca2++CO2↑+H2O
C.在澄清石灰水中通入少量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下流程探究碘的制取,甲乙两种制取方案如下:
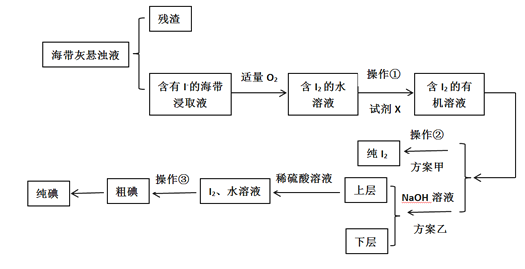
已知:3I2+6OH-=5I-+IO3-+3H2O;5I-+IO3-+6H+=3I2 +3H2O;酸性条件下,I2在水溶液中的溶解度极小。
(1)灼烧海带时,除需要三脚架,泥三角外,还需要用到的实验仪器为___。
A.烧杯 B.表面皿 C.坩埚 D.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①___;②___;③___。
(3)有机试剂X可以是___(填序号)
A.四氯化碳 B.乙醇 C.醋酸
(4)下列关于加入NaOH溶液操作的说法,正确的是___。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除浸取原液中的杂质 D.NaOH溶液可由乙醇代替
(5)方案甲中采用操作②会导致碘的损失,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) △H<0,在低温下获得高转化率与高反应速率。反应过程示意图如图:
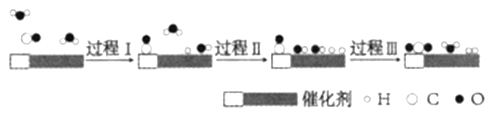
下列说法正确的是( )
A. 过程Ⅰ为放热过程、过程Ⅱ为吸热过程B. 过程Ⅲ只生成了非极性共价键
C. 图示显示:起始时的2个H2O都参与了反应D. 使用催化剂降低了水煤气变换反应的△H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com