
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) △H<0,在低温下获得高转化率与高反应速率。反应过程示意图如图:
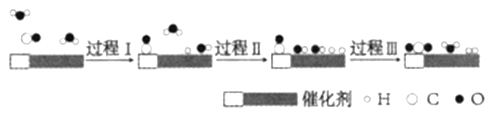
下列说法正确的是( )
A. 过程Ⅰ为放热过程、过程Ⅱ为吸热过程B. 过程Ⅲ只生成了非极性共价键
C. 图示显示:起始时的2个H2O都参与了反应D. 使用催化剂降低了水煤气变换反应的△H
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)147gH2SO4的物质的量是_______;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_____,_____元素化合价降低;______作还原剂,_____发生还原反应。
(4)钠在空气中燃烧的化学方程式:_____,1mol钠完全燃烧转移电子的个数为______(阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜的提炼多从黄铜矿开始,黄铜矿在焙烧过程中主要反应之一的化学方程式为![]()
![]() 。下列说法正确的是( )
。下列说法正确的是( )
A. 每生成![]() ,有4mol硫被氧化
,有4mol硫被氧化
B. ![]() 只作还原剂,
只作还原剂,![]() 只作氧化剂
只作氧化剂
C. ![]() 既是氧化产物又是还原产物
既是氧化产物又是还原产物
D. 若有![]() 参加反应,则上述反应中共有
参加反应,则上述反应中共有![]() 转移
转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是( )
A. 由Na和Cl形成离子键的过程:![]()
B. NH5的结构与NH4Cl相似,NH5的结构式: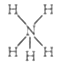
C. 中子数为20的氯原子:![]()
D. 乙烯的分子式:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
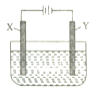
【题目】(1)电解原理具有广泛应用,如图为在铁上镀铜的简易装置示意图,则X极材料为___, 电极反应式为___;电解质溶液为___。
(2)燃料电池是一种将燃料所具有的化学能直接转化成电能的装置。
①以多孔铂为电极,如图装置中 A、B 口分别通入CH3 CH2OH和O2构成燃料电池模型,该电池负极的电极反应式为___。
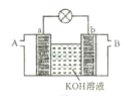
②科学家研究了转化温室气体的方法,利用如图所示装置可以将CO2 转化为气体燃料CO,该电池正极的电极反应式为___。
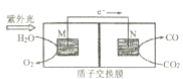
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是门捷列夫提出元素周期表150周年,联合国将2019年定为“国际化学元素周期表年”。已知短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法正确的是( )

A. W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
B. 在元素周期表中,117号元素与Z元素位于同一主族
C. 氧化物对应水化物的酸性:Z>Y
D. W、X、Y、Z四种元素对应的单质的沸点:W<X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中所含离子推断正确的是( )
A. 向溶液中滴加酸化的![]() 溶液出现白色沉淀,该溶液中一定有
溶液出现白色沉淀,该溶液中一定有![]()
B. 向溶液中滴加氯水后,再滴加![]() 溶液,溶液变为红色,该溶液中一定有
溶液,溶液变为红色,该溶液中一定有![]()
C. 向溶液中滴加稀![]() 溶液,将湿润的红色石蒸试纸置于试管口,试纸不变蓝,该溶液中一定无
溶液,将湿润的红色石蒸试纸置于试管口,试纸不变蓝,该溶液中一定无![]()
D. 向溶液中逐渐通入![]() 气体,先出现白色胶状沉淀,继续通入
气体,先出现白色胶状沉淀,继续通入![]() 气体,白色胶状沉淀不溶解,该溶液中不一定含有
气体,白色胶状沉淀不溶解,该溶液中不一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分类是学习化学的一种重要方法,科学合理的分类对于提高学习效率、解决问题都有着重要的意义。请回答下列问题:
I. 纯净物根据其组成和性质有如图分类形式

图中所示所属的分类方法为__________________。
II. 有以下13种物质①石墨 ②过氧化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钠溶液 ⑧纯醋酸 ⑨氯化氢 ⑩硫酸铝 稀硫酸 氯化银 硫酸氢钠
(1)属于电解质的是 _________;属于非电解质的是 _________。
(2)写出下列物质溶于水的电离方程式:⑥__________________;⑩___________________;
(3)写出物质⑥和⑦反应的离子方程式:___________________。
(4)写出物质⑥和在水中发生反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、 |
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是______________,一定不含有的阳离子是_____________(写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是___________________________,④中生成白色沉淀的离子方程式是___________________________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生反应的化学方程式为__________________________。
(4)该同学最终确定原溶液中所含阴离子是___________,阳离子是________________写离子符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com