
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、 |
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是______________,一定不含有的阳离子是_____________(写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是___________________________,④中生成白色沉淀的离子方程式是___________________________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生反应的化学方程式为__________________________。
(4)该同学最终确定原溶液中所含阴离子是___________,阳离子是________________写离子符号)。
【答案】![]() 、
、![]() K+、Fe3+ 3Fe2++
K+、Fe3+ 3Fe2++![]() +4H+=3Fe3++NO↑+2H2O Ba2++
+4H+=3Fe3++NO↑+2H2O Ba2++![]() =BaSO4↓ 3NO2+H2O=2HNO3+NO Cl-、
=BaSO4↓ 3NO2+H2O=2HNO3+NO Cl-、![]() 、
、![]() Fe2+、Mg2+
Fe2+、Mg2+
【解析】
用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察),说明没有K+;
②取少量溶液,加入KSCN溶液无明显变化,说明没有Fe3+;
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变,说明Fe2+与NO3和H+反应生成NO,即溶液中有Fe2+、NO3,加盐酸溶液中阴离子种类不变,说明原溶液中有Cl无![]() ,加盐酸溶液依然澄清说明没有SiO32;
,加盐酸溶液依然澄清说明没有SiO32;
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明有SO42;
(1)由①、②、③判断,溶液中一定不含有的阳离子是K+、Fe3+,一定不含有的阳离子是![]() 、SiO32;故答案为:
、SiO32;故答案为:![]() 、SiO32;K+、Fe3+;
、SiO32;K+、Fe3+;
(2) ③中加入少量盐酸生成无色气体,是Fe2+与NO3和H+反应生成NO,其离子方程式:3Fe2++NO3+4H+═3Fe3++NO↑+2H2O;
故答案为:3Fe2++NO3+4H+═3Fe3++NO↑+2H2O;
(3)将③中所得红棕色气体为二氧化氮,通入水中,与水反应生成NO,气体变无色,所发生的化学方程式为3NO2+H2O=2HNO3+NO,向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,离子方程式是Ba2++![]() =BaSO4↓;
=BaSO4↓;
故答案为:3NO2+H2O=2HNO3+NO;Ba2++![]() =BaSO4↓;
=BaSO4↓;
(4)由以上推断可知溶液中阴离子为Cl、NO3、SO42,且各为0.1mol/L;已经推断出的阳离子是Fe2+,其浓度为0.1mol/L,由电荷守恒可知溶液中还有一种+2价阳离子,所以还有Mg2+,所以甲同学最终确定原溶液中所含阳离子是:Fe2+、Mg2+;阴离子是:Cl、NO3、SO42;
故答案为:、NO3、SO42、Cl; Fe2+、Mg2+


科目:高中化学 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) △H<0,在低温下获得高转化率与高反应速率。反应过程示意图如图:
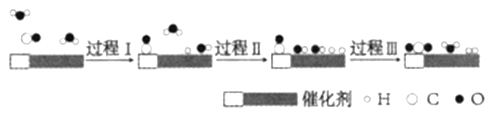
下列说法正确的是( )
A. 过程Ⅰ为放热过程、过程Ⅱ为吸热过程B. 过程Ⅲ只生成了非极性共价键
C. 图示显示:起始时的2个H2O都参与了反应D. 使用催化剂降低了水煤气变换反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是
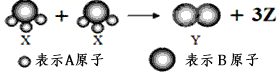
A.根据质量守恒定律可推知,1个Z分子中含有2个同种元素的原子
B.X、Y、Z三种物质均属于非电解质
C.该反应属于氧化还原反应
D.该反应属于分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
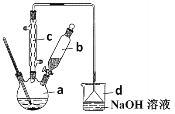
【题目】溴苯是一种化工原料,实验室合成溴苯装置图及有关数据如下:
项目 | 苯 | 溴 | 溴苯 |
密度/(g·cm-3) | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴。仪器c的名称是____________,其进水口为_____(填“上”或“下”)口,装置d中倒置漏斗作用为________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_______。
③向分出的粗溴苯中加入少量的无水硫酸镁,静置、过滤。
(3)经以上分离操作后,要进一步提纯,下列操作中必需的是____(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)将d中的NaOH溶液换成硝酸银溶液,则出现的现象为_____________,该现象_____(填“能”或“不能”)说明该反应为取代反应。
解决(3)时用到题干中的哪些信息_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图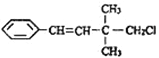 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )
A. 一定条件下,能发生加聚反应
B. 1mol该有机物在一定条件下最多能与4molH2发生反应
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 该有机物苯环上的一溴代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应:甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。乙同学仔细观察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中认为达到实验目的的两个反应的化学方程式:__________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________________________________ 。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
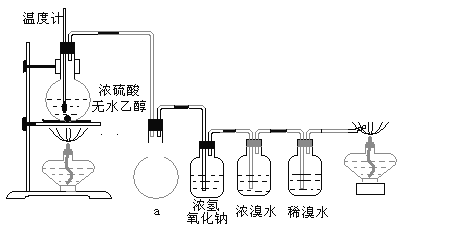
①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
稀溴水的作用是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是巨大的资源宝库,除了可以得到氯化钠还可以从海带中提取碘。碘是人 体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定 量的 KIO3 进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其 检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)氧化产物与还原产物的物质的量比是_____;如果反应生成 0.3mol 的单质碘,则转 移的电子数目是_____。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和 KI 溶液,最后加入一定量的 CCl4, 振荡,这时候,观察到的现象是_____。
(3)若采用下图实验装置将四氯化碳和 I2 的混合溶液分离。
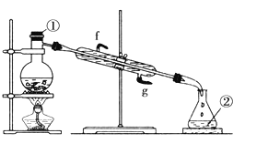
该装置还缺少的仪器是_______;冷凝管的进水口是:_______ (填 g 或 f)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
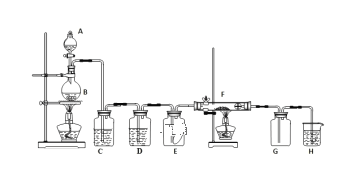
(1)装置C中盛装的溶液是___,D中试剂的作用是___。
(2)写出F中反应的化学反应方程式:__ ,其反应现象为___。
(3)H中的试剂为____,用来吸收多余氯气。该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性: Cl2>Br2>Fe3+>I2,则下列离子方程式正确的是:
A. 少量氯气与FeBr2溶液反应Cl2+2Br-=2C1-+Br2
B. 过量氯气与FeBr2溶液反应Cl2+Fe2++2Br-=2Cl-+Br2+Fe3+
C. 氯气与FeBr2溶液以物质的量1:1反应2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+
D. 少量氯气与FeI2溶液反应Cl2+2Fe2+=2Cl-+2Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com