
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
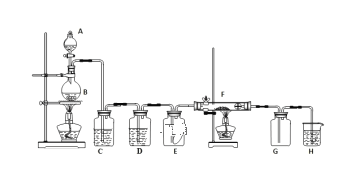
(1)装置C中盛装的溶液是___,D中试剂的作用是___。
(2)写出F中反应的化学反应方程式:__ ,其反应现象为___。
(3)H中的试剂为____,用来吸收多余氯气。该反应的离子方程式为___。
【答案】饱和食盐水 吸收氯气中混有的水蒸气 Cu+Cl2![]() CuCl2 棕黄色的烟 氢氧化钠溶液 Cl2+2OH-=Cl-+ClO-+H2O
CuCl2 棕黄色的烟 氢氧化钠溶液 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
实验室是利用二氧化锰和浓盐酸加热反应生成氯气,A中是浓盐酸,B中是二氧化锰固体,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;干燥的氯气遇到干燥有色布条不褪色,说明氯气无漂白作用。F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟,氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水。
MnCl2+Cl2↑+2H2O,生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气;干燥的氯气遇到干燥有色布条不褪色,说明氯气无漂白作用。F是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟,氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水。
(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,A中是浓盐酸,B中是二氧化锰固体,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,故C中是饱和食盐水;用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,故D中装的是浓硫酸。
MnCl2+Cl2↑+2H2O,生成的氯气中含有氯化氢,用饱和食盐水除去氯气中的氯化氢,故C中是饱和食盐水;用浓硫酸除去氯气中的水蒸气得到干燥纯净的氯气,故D中装的是浓硫酸。
(2)F是铜加热和氯气反应生成氯化铜的反应,方程式为:Cu+Cl2![]() CuCl2;生成的氯化铜形成棕色烟。
CuCl2;生成的氯化铜形成棕色烟。
(3)氯气有毒,不能排放到空气中,需要用氢氧化钠溶液吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】物质的分类是学习化学的一种重要方法,科学合理的分类对于提高学习效率、解决问题都有着重要的意义。请回答下列问题:
I. 纯净物根据其组成和性质有如图分类形式

图中所示所属的分类方法为__________________。
II. 有以下13种物质①石墨 ②过氧化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钠溶液 ⑧纯醋酸 ⑨氯化氢 ⑩硫酸铝 稀硫酸 氯化银 硫酸氢钠
(1)属于电解质的是 _________;属于非电解质的是 _________。
(2)写出下列物质溶于水的电离方程式:⑥__________________;⑩___________________;
(3)写出物质⑥和⑦反应的离子方程式:___________________。
(4)写出物质⑥和在水中发生反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、 |
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是______________,一定不含有的阳离子是_____________(写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是___________________________,④中生成白色沉淀的离子方程式是___________________________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生反应的化学方程式为__________________________。
(4)该同学最终确定原溶液中所含阴离子是___________,阳离子是________________写离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1 mol该烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4 L,同时得到16.2 g水。
(1)该烃的摩尔质量为________。
(2)该烃的分子式为________。
(3)该烃有一种可能的结构为  ,属于________(选填序号)。
,属于________(选填序号)。
A.环烃 B.烷烃 C.芳香烃 D.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
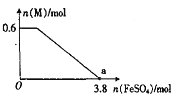
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生如下反应:
①![]()
②![]()
③![]()
根据上述反应提供的信息,判断下列结论不正确的是
A.氧化性:XO4—>B2>A3+
B.X2+既有还原性,又有氧化性
C.还原性:Z—>A2+
D.溶液中可发生:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.向小苏打溶液中加入硫酸氢钠溶液:![]()
B.碳酸镁与稀硫酸反应:![]()
C.金属铝溶于盐酸中:![]()
D.向稀硫酸中加入氢氧化钡溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,分子数不相同的是
A.同温同压下 2 L SO2 和 2 L CO2
B.标准状况下 1mol 氧气和 22.4 LSO3
C.9g 水和标准状况下 11.2 L CO2
D.0.2mol 氯气和 7.3g 氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃(聚甲基丙烯酸甲酯、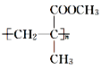 )广泛应用于商业、轻工业、建筑、化工甚至人工角膜等方面,下面是工业上由丙酮为起始反应物合成有机玻璃的一种路线图,请回答下列问题:
)广泛应用于商业、轻工业、建筑、化工甚至人工角膜等方面,下面是工业上由丙酮为起始反应物合成有机玻璃的一种路线图,请回答下列问题:
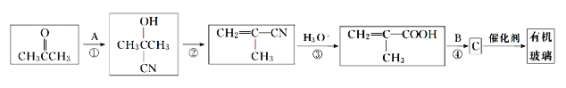
(1)A的化学式为__________;B的名称是_______。
(2)反应①、②的反应类型分别是____________、___________。
(3)下列有关![]() 的说法错误的是________(填字母)。
的说法错误的是________(填字母)。
a.分子中所有碳原子均在同一平面上 b.能使溴水、酸性KMnO4溶液褪色
c.与丙酸互为同系物 d.能与新制的Cu(OH)2悬浊液反应
(4)写出反应④的化学方程式:_____________。
(5)C有多种同分异构体,其中满足下列条件的有______种(不包含C),在这些同分异构体中,核磁共振氢谱有3组峰的物质的结构简式为_______________。
①能发生水解反应但不能发生银镜反应; ②能使溴的CCl4溶液褪色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com