
【题目】海洋是巨大的资源宝库,除了可以得到氯化钠还可以从海带中提取碘。碘是人 体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定 量的 KIO3 进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其 检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)氧化产物与还原产物的物质的量比是_____;如果反应生成 0.3mol 的单质碘,则转 移的电子数目是_____。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和 KI 溶液,最后加入一定量的 CCl4, 振荡,这时候,观察到的现象是_____。
(3)若采用下图实验装置将四氯化碳和 I2 的混合溶液分离。
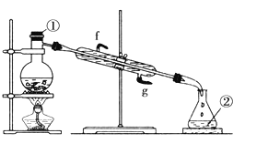
该装置还缺少的仪器是_______;冷凝管的进水口是:_______ (填 g 或 f)。
【答案】5:1 0.5NA或3.01×1023 溶液分层,上层无色,下层紫红色 温度计 g
【解析】
(1)结合KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4反应并根据氧化还原反应规律进行分析;
(2)碘易溶于有机溶剂,碘的CCl4溶液为紫红色,且在下层;
(3)根据蒸馏操作所需的仪器及操作要求进行分析。
(1)KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4反应中,KIO3中碘由+5价降低到I2中的0价,化合价降低了5价,1molKIO3反应转移了5mole-; KIO3 发生还原反应,对应的还原产物为I2,1mol KIO3发生还原反应生成碘的物质的量为0.5mol;KI中碘由-1价升高到I2中的0价,化合价升高了1价,5molKI反应转移了5mole-;KI发生氧化反应,对应氧化产物为I2,5mol KI发生氧化反应生成碘的物质的量为2.5mol,所以氧化产物与还原产物的物质的量比是2.5:0.5=5:1;根据3I2~5e-可知,如果反应生成 0.3mol 的单质碘,则转移的电子数目是0.5NA或3.01×1023 ;
故答案是:5:1; 0.5NA或3.01×1023 ;
(2)四氯化碳的密度比水大,四氯化碳与水互不相溶,碘易溶于有机溶剂,因此反应后的混合物中加入CCl4,振荡静置后溶液分层,碘进入CCl4层,溶液为紫红色,且在下层;
故答案是:溶液分层,上层无色,下层紫红色
(3)蒸馏装置中需要用温度计控制馏分的温度,所以该套实验装置还缺少的仪器是温度计;为保证较好的冷凝效果,冷却水应该下进上出,即冷凝管的进水口是g;
故答案是:温度计;g。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中所含离子推断正确的是( )
A. 向溶液中滴加酸化的![]() 溶液出现白色沉淀,该溶液中一定有
溶液出现白色沉淀,该溶液中一定有![]()
B. 向溶液中滴加氯水后,再滴加![]() 溶液,溶液变为红色,该溶液中一定有
溶液,溶液变为红色,该溶液中一定有![]()
C. 向溶液中滴加稀![]() 溶液,将湿润的红色石蒸试纸置于试管口,试纸不变蓝,该溶液中一定无
溶液,将湿润的红色石蒸试纸置于试管口,试纸不变蓝,该溶液中一定无![]()
D. 向溶液中逐渐通入![]() 气体,先出现白色胶状沉淀,继续通入
气体,先出现白色胶状沉淀,继续通入![]() 气体,白色胶状沉淀不溶解,该溶液中不一定含有
气体,白色胶状沉淀不溶解,该溶液中不一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体Na2CO3配制90mL 0.200 mol·L-1的Na2CO3溶液,回答下列问题:
(1)通过计算得出可用天平称取Na2CO3固体________g。
(2)若要实施配制,除天平、烧杯、玻璃棒外,还需的玻璃仪器有 _______ ,______。
(3)溶解过程中,玻璃棒的作用是__________________。
(4)配制完毕后,教师指出有四位同学进行了下列某一项错误操作,你认为这四项错误操作中会导致所得溶液浓度偏低的是____(填选项字母)。
a.定容时俯视容量瓶刻度线
b.转移时未洗涤烧杯和玻璃棒
c.容量瓶使用时未干燥
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、 |
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是______________,一定不含有的阳离子是_____________(写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是___________________________,④中生成白色沉淀的离子方程式是___________________________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生反应的化学方程式为__________________________。
(4)该同学最终确定原溶液中所含阴离子是___________,阳离子是________________写离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84 消毒液”能有效杀灭甲型 H1N1 病毒,某同学购买了一瓶“威露士”牌“84 消毒液”,该消毒液通常稀释 100 倍(体积比)使用。查阅相关资料和消毒液包装说明得到 如下信息:
① ②NaClO = Na++ClO-
②NaClO = Na++ClO-
(1)该“84 消毒液”的物质的量浓度约为_____(保留 1 位小数)。
(2)某同学取 100mL 该“84 消毒液”,按要求稀释后用于消毒,稀释后的溶液中c(Na+)=_____mol·L1。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 480mL 含 NaClO 质量分数为25%的消毒液。下列说法不正确的是____________(填字母)。
A.如下图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.将称量好的 NaClO 固体在烧杯中溶解后应立即转入容量瓶
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO 固体的质量为 149.0g
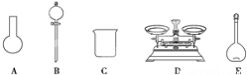
(4)该同学对容量瓶及其使用方法的认识中正确的是_____(填字母)。
A.容量瓶上标有容积、温度和浓度 B.使用前要检查容量瓶是否漏液 C.容量瓶用蒸馏水洗净后,须烘干后再使用 D.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
(5)一瓶上述“威露士”牌“84 消毒液”能吸收空气中_____L 的 CO2(标准状况)而变质。(已 知:CO2+NaClO+H2O=NaHCO3+HClO)
(6)“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1 的浓 硫酸配制 500 mL2.3 molL﹣1 的稀硫酸用于增强“84 消毒液”的消毒能力,需取用浓硫酸的体 积为______________mL。
(7)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_____(填代号)。
①用量筒量取 98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的 H2SO4 溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
(8)现有密度为 d g/mL 浓度为 18 mol/L 的浓硫酸溶液 100 g ,需要加入一定量的水将其 稀释为浓度是 9 mol/L,则加入水的体积是_____(填字母)
A.大于 100 mL B.小于 l00 mL C.等于 100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1 mol该烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4 L,同时得到16.2 g水。
(1)该烃的摩尔质量为________。
(2)该烃的分子式为________。
(3)该烃有一种可能的结构为  ,属于________(选填序号)。
,属于________(选填序号)。
A.环烃 B.烷烃 C.芳香烃 D.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
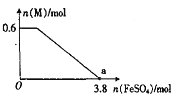
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.向小苏打溶液中加入硫酸氢钠溶液:![]()
B.碳酸镁与稀硫酸反应:![]()
C.金属铝溶于盐酸中:![]()
D.向稀硫酸中加入氢氧化钡溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com