
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价电子(外围电子)排布式为______________________________。
(2)硝酸钾中![]() 的空间构型为________,写出与
的空间构型为________,写出与![]() 互为等电子体的一种非极性分子化学式__________________________________________________________________。
互为等电子体的一种非极性分子化学式__________________________________________________________________。
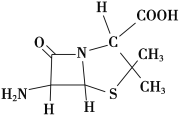
(3)6氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有____________。
(4)下列说法正确的有________(填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(CH2CH2)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)===SiO2(s)中,每生成60 g SiO2放出的能量为(2c-a-b) kJ
化学键 | Si—Si | O===O | Si—O |
键能(kJ·mol-1) | a | b | c |
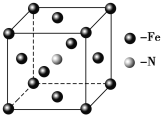
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式______________________________________。
 .
.
【答案】3d64s2 平面正三角形 BF3(SO3、BBr3等) C、N、O、S a 8Fe+2NH3![]() 2Fe4N+3H2
2Fe4N+3H2
【解析】
(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理书写其基态价电子排布式;
(2)根据价层电子对互斥理论确定离子空间构型,原子个数相等价电子数相等的微粒是等电子体,正负电荷重心重合的分子是非极性分子;
(3)根据价层电子对互斥理论确定碳原子杂化方式;
(4)a.氢键的存在影响物质的熔沸点;
b.根据化合物中化合价的代数和为0计算;
c.聚乙烯(![]() )分子中有(6n-1)个σ键;
)分子中有(6n-1)个σ键;
d.60gSiO2的物质的量=![]() mol=1mol,一个硅原子含有4个硅氧键;
mol=1mol,一个硅原子含有4个硅氧键;
(5)铁和氨气在640℃可发生置换反应生成氮气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式。
(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理知其价电子排布式为:3d64s2;
(2)NO3-中N原子价层电子对=3+![]() (5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构;与NO3-互为等电子体的一种非极性分子有BF3(SO3、BBr3等);
(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构;与NO3-互为等电子体的一种非极性分子有BF3(SO3、BBr3等);
(3)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片知,采用sp3杂化的原子有C、N、O、S;
(4)a.乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高,故a正确;
b.根据化合物中化合价的代数和为0知,钨的配合物离子[W(CO)5OH]-中钨显0价,故b错误;
c.聚乙烯(![]() )分子中有(6n-1)个σ键,故c错误;
)分子中有(6n-1)个σ键,故c错误;
d.由表中数据知反应Si(s)+O2(g)=SiO2(s)中,每生成60gSiO2放出的能量为(4c-2a-b)kJ,故d错误;
故答案为a;
(5)该晶胞中铁原子个数=8×![]() +6×
+6×![]() =4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3
=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3![]() 2Fe4N+3H2。
2Fe4N+3H2。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸氢钠粉末,pH增大,溶液漂白性增强
D. 光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
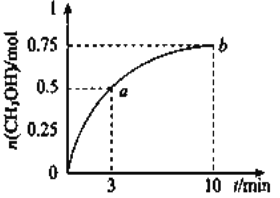
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
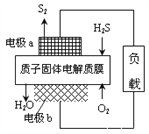
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
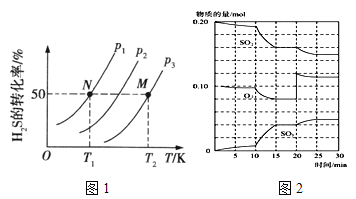
图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 LC.1.8 LD.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)147gH2SO4的物质的量是_______;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_____,_____元素化合价降低;______作还原剂,_____发生还原反应。
(4)钠在空气中燃烧的化学方程式:_____,1mol钠完全燃烧转移电子的个数为______(阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜的提炼多从黄铜矿开始,黄铜矿在焙烧过程中主要反应之一的化学方程式为![]()
![]() 。下列说法正确的是( )
。下列说法正确的是( )
A. 每生成![]() ,有4mol硫被氧化
,有4mol硫被氧化
B. ![]() 只作还原剂,
只作还原剂,![]() 只作氧化剂
只作氧化剂
C. ![]() 既是氧化产物又是还原产物
既是氧化产物又是还原产物
D. 若有![]() 参加反应,则上述反应中共有
参加反应,则上述反应中共有![]() 转移
转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com