
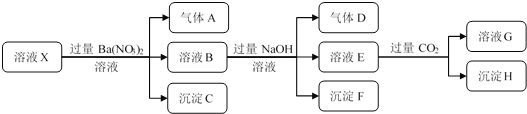
【题目】某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是()
A. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为112ml(标况),则X中c(Fe2+)=0.05mol/L
【答案】B
【解析】
在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,则A只能是NO,说明溶液中含有还原性离子,则一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀F只能为Fe(OH)3,生成气体D,则D为NH3,说明溶液中含有NH4+离子;溶液E中通入CO2气体,生成沉淀H,则H为Al(OH)3,E为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子和SO32-离子,那么一定含有SO42-离子,那么就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答。
依据分析可知:溶液中一定存在:NH4+、Al3+、Fe2+、SO42-,一定不含有:Ba2+、CO32-、SO32-、NO3-,不能确定是否含有:Fe3+和Cl-,
A、依据分析可知,溶液中一定存在:NH4+、Al3+、Fe2+、SO42-,不能确定Cl-是否存在,选项A错误;
B、根据上述连续实验不能确定溶液X中是否含有Fe3+,选项B正确;
C、根据上述分析可知H为Al(OH)3,BaCO3与过量的二氧化碳生成碳酸氢钡,易溶于水,选项C错误;
D、生成气体A的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的气体A为112 mL,物质的量为:![]() =0.005mol,故n(Fe2+)=3×0.005=0.015mol,c(Fe2+)==0.15mol/L,选项D错误;
=0.005mol,故n(Fe2+)=3×0.005=0.015mol,c(Fe2+)==0.15mol/L,选项D错误;
答案选B。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】铜元素在化合物中其化合价可以呈现![]() 、
、![]() 价。
价。![]() 和
和![]() 是常见的
是常见的![]() 价铜的化合物,
价铜的化合物,![]() 是较为常见的
是较为常见的![]() 价铜的化合物。
价铜的化合物。
(1)铜元素位于周期表的_______区。
A、s B、p C、d D、ds E、f
(2)向![]() 溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较
溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较![]() 和
和![]() 中
中![]() 键角的大小:
键角的大小:![]() ___________
___________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)![]() 中阴离子的空间构型为_______,NO3-中的大π键应表示为______
中阴离子的空间构型为_______,NO3-中的大π键应表示为______
[信息:臭氧分子中,中心氧原子的未杂化的p轨道(含2个电子)与其它两个氧原子的p轨道(各含1个电子)肩并肩形成一个大π键,表示为![]() ,]
,]
![]() 的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
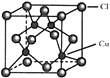
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②若以铜原子为顶点构成晶胞,面心原子为________(Cu、Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
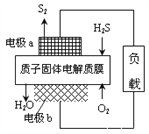
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 LC.1.8 LD.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室使用的浓盐酸的溶质的质量分数通常为36.5%,密度为1.25g/mL。
(1)该盐酸的物质的量浓度为__________mol/L。
(2)现有一种0.2mol/L的稀盐酸的含义是_________(选填字母)。
A.1L水中含有0.2mol HCl
B.1L溶液中含有0.1mol H+
C.将7.1gHCl溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为0.2mol/L
(3)用上述实验室的浓盐酸来配制500mL1 mol/L的稀盐酸,请在下列操作步骤中填写有关的空格:
①用量筒量取________mL的浓盐酸;(精确到小数点后一位)
②向盛有少量蒸馏水的烧杯中,沿_________慢慢注入浓盐酸;
③将已冷却至室温的盐酸溶液沿玻璃棒注入________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(4)由于操作不当,会引起实验误差。下列情况对所配制的盐酸溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;
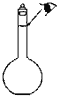
③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)147gH2SO4的物质的量是_______;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
2Cu2O +O2↑,若反应过程中生成1molO2分子,则转移电子数为________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_____,_____元素化合价降低;______作还原剂,_____发生还原反应。
(4)钠在空气中燃烧的化学方程式:_____,1mol钠完全燃烧转移电子的个数为______(阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移
B. 100 mL 1 mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
D. 84gNaHCO3固体含有CO32-离子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是( )
A. 由Na和Cl形成离子键的过程:![]()
B. NH5的结构与NH4Cl相似,NH5的结构式: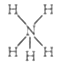
C. 中子数为20的氯原子:![]()
D. 乙烯的分子式:CH2=CH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com