
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含![]() 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品W g;
II.向样品中加人足量稀硫酸:
III.将II中产生的![]() ,用足量
,用足量![]() 溶液吸收;
溶液吸收;
IV.将III所得硫酸溶夜用氢氧化钠溶液滴定;
V.数据处理。
(1)![]() 是一种食品添加剂。写出
是一种食品添加剂。写出![]() 与稀
与稀![]() 反应的离子方程式:____________
反应的离子方程式:____________
(2)步骤中H2O2的作用是 __________________________
(3)步骤N中可选用的指示剂为__________。下图显示滴定终点时,滴定管(量程为25mL)读数为_______________。
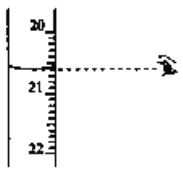
(4)步骤IV中消耗![]() 溶液V mL,则1 kg样品中含
溶液V mL,则1 kg样品中含![]() 的质量是__________g(用含W、V的代数式表示)。
的质量是__________g(用含W、V的代数式表示)。
(5)此实验方案测得亚硫酸盐含量偏低,步骤II会产生该误差,请说明理由。(写出2条)_______________________。
【答案】![]() 将
将![]() 氧化为
氧化为![]() 酚酞溶液 20.60mL
酚酞溶液 20.60mL ![]()
![]() 部分溶解在稀硫酸中、
部分溶解在稀硫酸中、![]() 与水反应、+4价硫被氧气氧化等
与水反应、+4价硫被氧气氧化等
【解析】
亚硫酸钠能与强酸反应放出SO2,有较强还原性的SO2能被过氧化氢氧化成硫酸,进而用中和滴定原理分析相关问题。
(1)H2SO3酸性弱于H2SO4,![]() 与稀
与稀![]() 反应的离子方程式
反应的离子方程式![]() ;
;
(2)步骤III中,利用H2O2较强的氧化性,将SO2氧化为![]() ,化学方程式H2O2+SO2=
,化学方程式H2O2+SO2=![]() ;
;
(3)步骤IV中,强碱滴定强酸,可选用酚酞或甲基橙作指示剂。滴定管由上向下读数,精度为0.01mL,故图中液面处读数为20.60mL;
(4)步骤IV中,n(NaOH)=0.01000mol/L×V×10-3L=V×10-5mol,据SO2~![]() ~2NaOH,则Wg样品含
~2NaOH,则Wg样品含![]() 质量:V×10-5mol××64g/mol=3.2×10-4×Vg,1 kg样品中含
质量:V×10-5mol××64g/mol=3.2×10-4×Vg,1 kg样品中含![]() 的质量是3.2×10-4×Vg/(W/1000)=
的质量是3.2×10-4×Vg/(W/1000)=![]() g;
g;
(5)据计算关系式,步骤IV消耗NaOH溶液偏少,使测得亚硫酸盐含量偏低。从步骤II看,是装置中逸出的SO2偏少,可能原因是①SO2溶解度较大,生成的SO2部分溶解于稀硫酸;②部分SO2残留在装置中没有被H2O2溶液吸收;③部分SO2被发生装置中的空气氧化;④装置气密性不良,有SO2逸到空气中。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W |
原子半径 | 160 | 143 | 70 | 66 |
主要化合价 |
|
|
|
|
下列叙述正确的是
A. X的电负性大于Y的电负性
B. W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键
C. Y的最高价氧化物对应的水化物能溶于稀硫酸和稀氨水
D. W的非金属性比Y强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和铁的氧化物等杂质)为原料制备铝与硫酸亚铁,工艺流程如图所示:请回答下列问题:
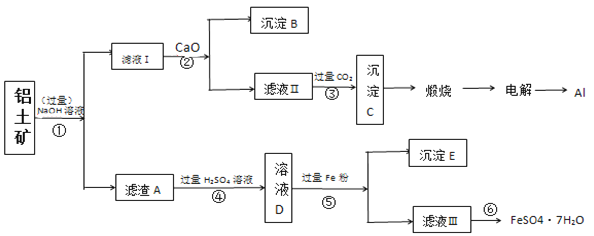
(1)步骤①中提高碱浸速率的方法_______。
(2)滤液Ⅰ中主要的阴离子是______,沉淀B的化学式____,步骤③的离子方程式:____。
(3)步骤⑤加入过量的铁粉的目的___(用离子方程式解释)
(4)检验滤液Ⅲ中的金属阳离子的方法是:_____。
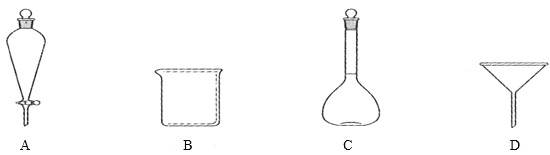
(5)滤液Ⅲ经过________,_______,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有___(填标号)。
(6)利用上述工艺流程测定铝土矿中铁元素的质量分数,取10g样品,最终得到5.56g的FeSO4·7H2O晶体,该铝土矿中铁元素的质量分数_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
1/4CaS(s)+CO2(g) △H = - 47.3kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
平衡常数K的表达式为 。
(2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
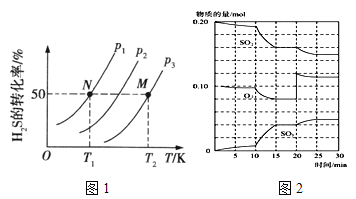
图1中压强p1、p2、p3的大小顺序为 ,理由是 ;该反应平衡常数的大小关系为K(T1) K(T2) (填“>”、“<”或“=”),理由是 。
(3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是 。
②据图2判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喹硫平可用于精神疾病的治疗,它的合成路线如下:
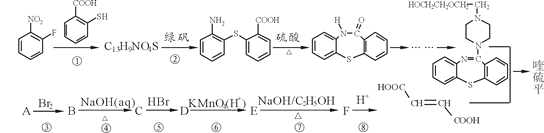
(1)写出C13H9NO4S中所有含氧官能团的名称__________。
(2)A属于烃,且相对分子质量是54,写出A的结构简式_______________。
(3)反应①~⑤中属于取代反应的有____(选填序号)。
写出反应⑦的化学方程式________________。
(4)流程中设计反应⑤和⑦的目的是_____________________。
(5)物质C的同分异构体有多种,其中既含有羟基,又含有醛基的同分异构体有____种。
(6)已知:苯环上的羧基为间位定位基,如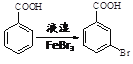 。写出以
。写出以![]() 为原料制备
为原料制备 的合成路线流程图(无机试剂任选,可利用本题中的相关信息)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选,可利用本题中的相关信息)。合成路线流程图示例如下:![]() 。_____________
。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O,试完成下面的问题:
CuSO4+A↑+2H2O,试完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______(用字母代号填写)
a.酸 b. 碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)该反应中被氧化的元素是_________________,参加反应的氧化剂与还原剂的物质的量之比为______。
(3)写出该反应的化学方程式并用双线桥标出电子转移的方向和数目:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含![]() 、FeO,杂质为
、FeO,杂质为![]() 和
和![]() 等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)FeOOH中Fe元素的化合价为____。
(2)“酸溶”时,所选择的硫酸为溶质质量分数49%,密度![]() ,该硫酸物质的量浓度是___
,该硫酸物质的量浓度是___![]() ,
,![]() 反应的离子方程式为____。
反应的离子方程式为____。
(3)滤渣Ⅰ的主要成分是![]() 和___(填化学式);
和___(填化学式);![]() 被
被![]() 还原的离子方程式为_____。
还原的离子方程式为_____。
(4)“氧化”中,需检验溶液中的离子是否氧化完全,所选用的试剂是____。
(5)滤液Ⅱ中溶质是___(填化学式);洗涤固体的操作是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com