
����Ŀ��������������־����־�����������й��ڰ�ͭ�ļ��أ���������ͭ��ͭ���Ͻ��������⣬����Ҫ������ң������������������Ʒ���ش��������⣺
(1)��Ԫ�صĻ�̬�۵����Ų�ʽΪ_____________��3d�ܼ��ϵ�δ�ɶԵĵ�����Ϊ______��
(2)���������ڰ�ˮ�γ�[Ni(NH3)6]SO4��ɫ��Һ��
��[Ni(NH3)6]SO4�������ӵ����幹����___________��
����[Ni(NH3)6]2+��Ni2+��NH3֮���γɵĻ�ѧ����Ϊ______________���ṩ�µ��ӶԵijɼ�ԭ����_____________��
�۰��ķе�_________�������������������������(PH3)��ԭ����__________________������_________���ӣ����������������Ǽ�������������ԭ�ӵĹ���ӻ�����Ϊ_______��
(3)����ͭ����������______________���γɵľ��塣
(4)ij����ͭ�Ͻ�����������ṹ��ͼ��ʾ��
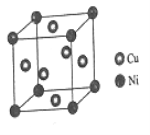
�پ�����ͭԭ������ԭ�ӵ�������Ϊ___________��
�����Ͻ���ܶ�Ϊdg/cm3�������߳�a=______________nm��
���𰸡�3d84s2 2 �������� ��λ�� N ���� NH3���Ӽ���γ���� ���� sp3 ���� 3:1 ![]() ��107
��107
��������
(1)Ni��28��Ԫ�أ���ԭ�Ӻ�����28�����ӣ����ݹ���ԭ����д��Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽ��3d�ܼ��ϵ�δ�ɶԵĵ�����Ϊ2��
(2)��[Ni(NH3)6]SO4�������ӵļ۲���ӶԸ���=4+![]() ���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���������ӵ����幹�ͣ�
���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���������ӵ����幹�ͣ�
�ں��йµ��ӶԺͺ��пչ����ԭ��֮�������λ�����ṩ�µ��ӶԵijɼ�ԭ����Nԭ����
����������⻯���۷е�ϸߣ�
�������ӽṹ���Գƣ�����������IJ��غϣ���������������ԭ��Nԭ�ӵļ۲���ӶԸ���=3+![]() ���Һ���һ���µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Nԭ�ӵĹ���ӻ����ͣ�
���Һ���һ���µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Nԭ�ӵĹ���ӻ����ͣ�
(3)���������д��ڽ�������
(4)�ٸþ�����Niԭ�Ӹ���=8��![]() =1��Cuԭ�Ӹ���=6��
=1��Cuԭ�Ӹ���=6��![]() =3��
=3��
�ڸþ����Ļ�ѧʽΪCu3Ni�����Ͻ���ܶ�Ϊdg/cm3�����ݾ����ܶȹ�ʽ���㾧��������
(1)Ni��28��Ԫ�أ���ԭ�Ӻ�����28�����ӣ����ݹ���ԭ����д��Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d84s2��[Ar]3d84s2��3d�ܼ��ϵ�δ�ɶԵĵ�����Ϊ2��
��2����[Ni(NH3)6]SO4�������Ӽ۲���ӶԸ���=4+![]() ���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���������ӵ����幹��Ϊ����������
���Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж���������ӵ����幹��Ϊ����������
�ں��йµ��ӶԺͺ��пչ����ԭ��֮�������λ������[Ni(NH3)6]2+��Ni2+�ṩ�չ����NH3�ṩ�µ��Ӷԣ�������[Ni(NH3)6]2+��Ni2+��NH3֮���γɵĻ�ѧ����Ϊ��λ�����ṩ�µ��ӶԵijɼ�ԭ����Nԭ�ӣ�
����������⻯���۷е�ϸߣ������к����������в�����������۷е�������
�������ӽṹ���Գƣ�����������IJ��غϣ�����Ϊ���Է��ӣ���������������ԭ��Nԭ�ӵļ۲���ӶԸ���=3+![]() ���Һ���һ���µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Nԭ�ӵĹ���ӻ�����Ϊsp3�ӻ���
���Һ���һ���µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Nԭ�ӵĹ���ӻ�����Ϊsp3�ӻ���
(3)���������д��ڽ���������������к��н�������
(4)�ٸþ�����Niԭ�Ӹ���=8��![]() =1��Cuԭ�Ӹ���=6��
=1��Cuԭ�Ӹ���=6��![]() =3����Cu��Niԭ�Ӹ���֮��Ϊ3��1��
=3����Cu��Niԭ�Ӹ���֮��Ϊ3��1��
�ڸþ����Ļ�ѧʽΪCu3Ni�����Ͻ���ܶ�Ϊdg/cm3�����ݾ����ܶȼ���ʽ![]() ��������l=
��������l=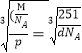 ��107nm��
��107nm��


 ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƾ���ǿ�����ԣ�����˵������ȷ����( )
A.�����������������Ӧʱ������������
B.1mol������������������ĿԼΪ6.02��1023
C.Na2O2��CO2��Ӧʱ��Na2O2����������CO2�ǻ�ԭ��
D.�������ʵ�����Na2O��Na2O2�ֱ����ڵ�����������ˮ��������Һ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʼ䷢����Ӧ�����ĵ����ʵ������ᣬ��������������
A. ľ̿��Ũ����B. ͭ��ϡ����C. п��ϡ����D. ľ̿��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���Ƿ���ȷ
��1�� | ��2�� | ��3�� | ��4�� |
___ | ___ | ___ | ___ |
��1��22.4LO2��һ������6.02��1023��������
��2����80gNaOH����1Lˮ�У�������Һ��NaOH�����ʵ���Ũ��Ϊ2mol/L
��3��18gH2O�ڱ�״���µ������22.4L
��4���ڱ�״��ʱ��20mLNH3��60mLO2�����ķ��Ӹ�����Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ�������һ����������巢����Ӧ��x A(g)��y B(g) ![]() z C(g)ƽ��ʱ���A��Ũ��Ϊ0.5 mol/L�������¶Ȳ��䣬���������ݻ�����ԭ����2�����ٴ�ƽ��ʱ���A��Ũ��Ϊ0.2 mol/L�������ж���ȷ����
z C(g)ƽ��ʱ���A��Ũ��Ϊ0.5 mol/L�������¶Ȳ��䣬���������ݻ�����ԭ����2�����ٴ�ƽ��ʱ���A��Ũ��Ϊ0.2 mol/L�������ж���ȷ����
A. ƽ�����淴Ӧ�����ƶ�B. x��y<z
C. C������������ֲ���D. B��ת���ʽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ�����й��ڸ��л��������˵��������ǣ� ��
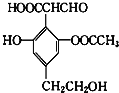
A. 1mol�����ʿ���4mol����������Һ��Ӧ
B. ��NaHCO3��Һ��Ӧ���Բ���CO2����
C. ��������H2��Ӧ��1mol�������������3mol H2
D. �����ʿ���ʹ����KMnO4��Һ��ɫ��Ҳ�ɷ�����ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ����÷�Ӧ��3Cu+8HNO3=3Cu��NO3��2+2NO��+4H2O����ȡNO������6.4gCu�μӷ�Ӧʱ�����㣺
��1����˫���ŷ��������ת�Ƶ��������Ŀ��
��2�������ɶ�����NO����״��������
��3��ʹ���ɵ�Cu��NO3��2��Cu2+ȫ��ת���ɳ�������������Ҫ��������Ϊ40%�ܶ�Ϊ1.42g/ml��NaOH��Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ������
Ԫ�ش��� | X | Y | Z | W |
ԭ�Ӱ뾶 | 160 | 143 | 70 | 66 |
��Ҫ���ϼ� |
|
|
|
|
����������ȷ����
A. X�ĵ縺�Դ���Y�ĵ縺��
B. W���⻯���ͬ������Ԫ�ص��⻯���ȶ�������ΪW���⻯���д������
C. Y������������Ӧ��ˮ����������ϡ�����ϡ��ˮ
D. W�ķǽ����Ա�Yǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(��Ҫ�ɷ�ΪAl2O3����SiO2�����������������)Ϊԭ���Ʊ�������������������������ͼ��ʾ����ش��������⣺
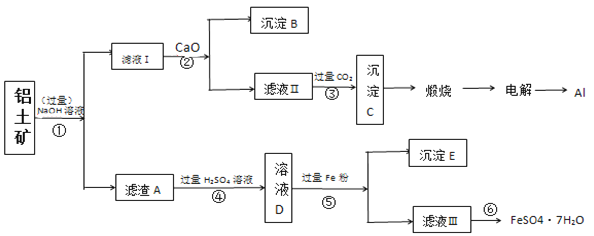
��1����������������ʵķ���_______��
��2����Һ������Ҫ����������______������B�Ļ�ѧʽ____������۵����ӷ���ʽ��____��
��3������ݼ�����������۵�Ŀ��___�������ӷ���ʽ���ͣ�
��4��������Һ���еĽ��������ӵķ����ǣ�_____��
��5����Һ��________��_______�����˵õ������������壬����ʱ��Ҫ�IJ���������___�����ţ���
��6�����������������̲ⶨ����������Ԫ�ص�����������ȡ10g��Ʒ�����յõ�5.56g��FeSO4��7H2O���壬������������Ԫ�ص���������_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com