
【题目】过氧化钠具有强氧化性,下列说法不正确的是( )
A.过氧化钠与二氧化硫反应时可生成硫酸钠
B.1mol过氧化钠中阴离子数目约为6.02×1023
C.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
D.将等物质的量的Na2O和Na2O2分别溶于等质量的足量水中所得溶液的质量相等
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4,⑨NH3H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为______________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH﹣)=_____;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_____。
(3)已知水存在如下平衡:H2O+H2O![]() H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_____。
H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_____。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃[其中c(H+)=1×10﹣6mol/L] D.向水中加入NH4Cl固体
(4)若浓度均为0.1mol/L、等体积的NaOH和NH3H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 m_____n(填“<”、“>”或“=”)。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_____。
(6)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
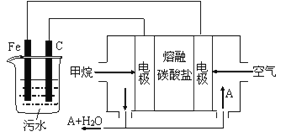
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH
(2)电解池阳极发生了两个电极反应,电极反应式分别是
Ⅰ.___________________; Ⅱ._________________;
(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是__________________;
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
①负极的电极反应是____________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是动物必需的营养元素和植物有益的营养元素,可以形成SeO2、H2SeO3、H2SeO4等化合物。
(1)硒的原子结构示意图可表示为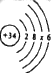 ,则x的值为_____。
,则x的值为_____。
(2)向亚硒酸溶液中通入二氧化硫,有单质硒析出,写出该反应的化学方程式: _______。
(3)已知:Se(s)+H2(g)+2O2(g)=H2SeO4(s) ΔH1;
H2(g)+![]() O2(g)=H2O(l) ΔH2;
O2(g)=H2O(l) ΔH2;
2SeO2(g)+O2(g)+2H2O(l)=2H2SeO4(s) ΔH3。
则反应Se(s)+O2(g)=SeO2(g)的ΔH=____。(用含ΔH1、ΔH2、ΔH3的代数式表示)
(4)温度为T℃时,向2.0L恒容密闭容器中充入1.0molH2SeO3(g),发生反应:H2SeO3(g)![]() SeO2(g)+H2O(g) △H=+a kJ/mol。0~10min保持容器中温度不变,10min时改变一种条件,整个过程中H2SeO3(g)、SeO2(g)、H2O(g)的物质的量随时间的变化如图所示:
SeO2(g)+H2O(g) △H=+a kJ/mol。0~10min保持容器中温度不变,10min时改变一种条件,整个过程中H2SeO3(g)、SeO2(g)、H2O(g)的物质的量随时间的变化如图所示:
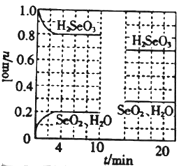
①要提高平衡时SeO2的体积分数,可采取的措施有______(填字母)。
a.容器体积不变,升高反应温度
b.使用高效催化剂
c.温度和容积不变,减小H2SeO3的起始量
d.温度不变,压缩容器体积,增大压强
②0~4min的平均反应速率v(H2O)=______;
③10min时改变的条件是_____;
④温度为T℃时,该反应的平衡常数K为______。若起始时向该容器中充入2.0mol H2SeO3(g)、1.0 mol SeO2(g)和0.15 mol H2O(g),反应达到平衡前,v(正)____(填“大于”“小于”或“等于”)v(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在,其单质和化合物在工农业生产中有着重要的作用。
(1)硫元素在周期表中的位置为___________,其最简单气态氢化物的电子式为_________。
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+![]() O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=_____________kJ·mol-1
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:

A瓶中发生反应的离子方程式为_______________________。B瓶中出现的现象为________。若要证明A、B的反应中SO2均显现还原性被氧化为SO42—,可以采取的操作和现象是_______________________________________。
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是__________(填序号)。

A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是


A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出如下化学反应方程式,如果是离子反应,则写离子反应方程式:
(1)氯气通入石灰乳中制取漂白粉:_________________________________
(2)漂白粉生效:_________________________________
(3)饱和的碳酸钠溶液中通入二氧化碳:_________________________________
(4)过氧化钠与二氧化碳反应:_________________________________
(5)次氯酸见光分解:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素的基态价电子排布式为_____________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______________,提供孤电子对的成键原子是_____________。
③氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是__________________;氨是_________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______________键形成的晶体。
(4)某镍白铜合金的立方晶胞结构如图所示。
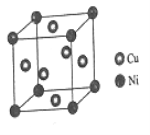
①晶胞中铜原子与镍原子的数量比为___________。
②若合金的密度为dg/cm3,晶胞边长a=______________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com