
【题目】瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为( )
A. 1:4 B. 1:2 C. 1:1 D. 2:1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
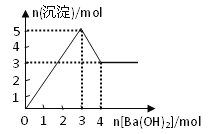
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制0.5 mol·L-1的NaOH溶液490mL。实验室提供以下仪器:①烧杯 ②100 mL量筒 ③药匙 ④玻璃棒 ⑤托盘天平(带砝码)。请回答下列问题:
(1)计算结果:需要称取NaOH固体的质量为____________;
(2)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是 _______________、______________。(填仪器名称)
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)__________;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)实验两次用到玻璃棒,其作用分别是:先用于________、后用于________;
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是_______________;
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A
④加蒸馏水时不慎超过了刻度
(6)若实验过程中出现(5)中④这种情况你将如何处理?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中发生反应2A2(g)+B2(g)![]() 2C(g) △H=—a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度进关闭K,向A、B容器中分别充入2molA2和1molB2,两容器分别在500℃时达到平衡,A中C的浓度为
2C(g) △H=—a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度进关闭K,向A、B容器中分别充入2molA2和1molB2,两容器分别在500℃时达到平衡,A中C的浓度为![]() mol/L,放出热量b kJ,B中C的浓度分别为
mol/L,放出热量b kJ,B中C的浓度分别为![]() mol/L,放出热量c kJ。请回答下列问题:
mol/L,放出热量c kJ。请回答下列问题:

(1)若将温度升高到700℃,反应的平衡常数将_____(填“增大”、“减小”、或“不变”)。
(2)比较大小: ![]() _____
_____![]() (填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(3)若打开K,一段时间后重新达到平衡,容器B的体积将_____(填“增大”、“减小”、或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 molA2和2 molB2,在500℃时达到平衡后C的浓度为![]() mol/L,则
mol/L,则![]() 、
、![]() 的关系为_____。
的关系为_____。
(5)能说明A中已达到平衡状态的是_____(填序号,有一个或多个选项符合题意)。
a. ![]() (C)=2
(C)=2![]() (B2) b. 容器内气体压强保持不变
(B2) b. 容器内气体压强保持不变
c. 容器中气体的平均相对分子质量不随时间而变化 d. 容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离出C气体 b. 适当升高温度 c. 增大B2的浓度 d. 选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是由A和CH2=CH2为主要原料合成的一种高分子酯类物质,合成路线如下(部分产物及条件已略去):
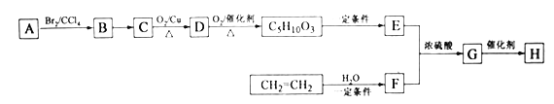
已知:①A的结构简式为: 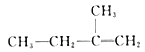
②E分子的核磁共振氢谱峰有4个,峰面积比为3:3:1:1.
(1)A的化学名称为__________
(2)F的结构简式为_________,B到C的反应条件是_________
(3)生成G的反应类型为_________,H的结构简式是_______,若H的平均相对分子质量为25600,则H的平均聚合度约为________
(4)C![]() D的化学方程式为_________
D的化学方程式为_________
(5)E有多种同分异构体,其中符合下列条件的同分异构体共有________种。
①能发生水解反应和银镜反应
②没有环状结构
③不含![]() 结构。
结构。
(6)写出以乙二醇为基本原料(其他试剂自选)合成聚乙二酸乙二酯的合成路线图(参照乙烯转化为F的格式)_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第________周期,该周期的元素种数是________;
(2)该元素处于元素周期表的第________族,该族的非金属元素种数是________;
(3)该元素处于元素周期表的________区,该区包括________族的元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com