
【题目】H是由A和CH2=CH2为主要原料合成的一种高分子酯类物质,合成路线如下(部分产物及条件已略去):
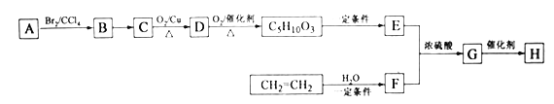
已知:①A的结构简式为: 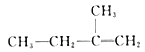
②E分子的核磁共振氢谱峰有4个,峰面积比为3:3:1:1.
(1)A的化学名称为__________
(2)F的结构简式为_________,B到C的反应条件是_________
(3)生成G的反应类型为_________,H的结构简式是_______,若H的平均相对分子质量为25600,则H的平均聚合度约为________
(4)C![]() D的化学方程式为_________
D的化学方程式为_________
(5)E有多种同分异构体,其中符合下列条件的同分异构体共有________种。
①能发生水解反应和银镜反应
②没有环状结构
③不含![]() 结构。
结构。
(6)写出以乙二醇为基本原料(其他试剂自选)合成聚乙二酸乙二酯的合成路线图(参照乙烯转化为F的格式)_____.
【答案】 2-甲基-1-丁烯 CH3CH2OH NaOH水溶液、加热 取代反应 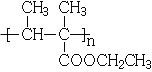 200
200 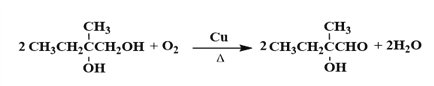 4
4 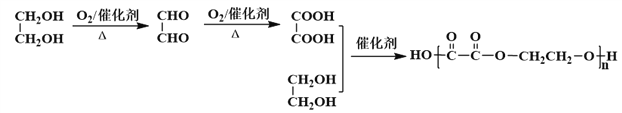
【解析】A与Br2/CCl4发生加成反应生成B: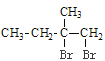 ;B在NaOH水溶液发生水解反应,生成C:
;B在NaOH水溶液发生水解反应,生成C: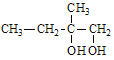 ;C在O2/Cu△的条件下转化为D,与亚甲基相连的羟基被氧化为羧基,所以D为:
;C在O2/Cu△的条件下转化为D,与亚甲基相连的羟基被氧化为羧基,所以D为: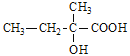 ;在浓硫酸加热的条件下D中的羟基脱水生成碳碳双键,则E为
;在浓硫酸加热的条件下D中的羟基脱水生成碳碳双键,则E为![]() ;F为乙醇,F与E在浓硫酸加热的条件下生成G,G为
;F为乙醇,F与E在浓硫酸加热的条件下生成G,G为![]() 。
。
综上所述,B为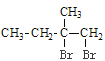 ,C为
,C为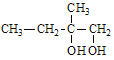 ,D为
,D为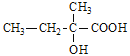 ,E为
,E为![]() ,G为
,G为![]() 。
。
(1)A为 ![]() ,化学名称为2-甲基-1-丁烯
,化学名称为2-甲基-1-丁烯
(2)F为乙醇,结构简式为CH3CH2OH,B到C为卤代烃的水解反应,反应条件是NaOH水溶液、加热
(3)生成G的反应为酯化反应,因此反应类型为取代反应,G→H为加聚反应,H的结构简式是 ,若H的平均相对分子质量为25600,则H的平均聚合度约为n=25600/128=200;
,若H的平均相对分子质量为25600,则H的平均聚合度约为n=25600/128=200;
(4)C![]() D是醇的催化氧化,叔醇不被氧化,化学方程式为
D是醇的催化氧化,叔醇不被氧化,化学方程式为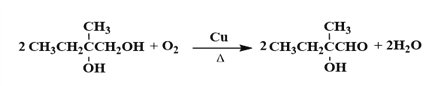
(5)①能发生水解反应说明含酯基,能发生银镜反应说明含有醛基,即应含有HCOO-结构,②没有环状结构,③不含![]() 结构。则满足要求的结构为:
结构。则满足要求的结构为:![]() 、
、![]() 、
、![]() 、
、![]() 共4种。
共4种。
(6)参照题中所给合成路线,乙二醇→乙二醛→乙二酸→聚乙二酸乙二酯,故合成路线图为: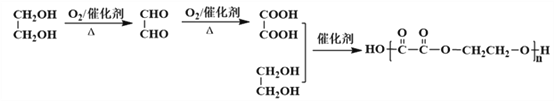


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向烧杯分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=3∶4,则加入铝粉的质量为
A. 1.8 g B. 2.7 g C. 3.6 g D. 5.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)一空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用情性电极电解硫酸铜溶液,实验装置如图所示。下列说法正确的是

A. VB2电极的电极反应式为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中SO42-向b电极移动
D. 电解过程中,b电极表面有红色物质析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;溶液中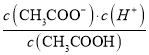 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________(填“酸”、“碱”或“中”,下同)性,NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______________________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气________。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18纵行,下图中实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为下列几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自构造原理最后填入的电子的能级符号。
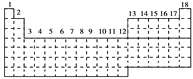
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影![]() 和
和![]() 表示d区和ds区____。
表示d区和ds区____。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在__________区。
(3)在元素周期表中4s轨道半充满的元素为__________(填元素符号)
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:3S+6KOH![]() 2K2S+K2SO3+3H2O,下列说法中正确的是 ( )
2K2S+K2SO3+3H2O,下列说法中正确的是 ( )
A. 硫是氧化剂,KOH是还原剂 B. 反应中共转移8 mol电子
C. 还原剂和氧化剂的质量比是1∶2 D. 氧化产物和还原产物的质量比是1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等8种物质存在如下转化关系(反应条件,部分产物未标出)。已知:A是正盐,B是能使品红溶液退色的气体,G是红棕色气体。按要求回答问题:
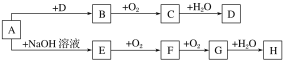
(1)写出下列物质的化学式:A____________,B____________。
(2)写出下列反应的化学方程式:
E→F___________________G→H__________________;D的溶液与木炭反应的化学方程式: ________________。
(3)检验某溶液中是否含D中阴离子的方法是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com