
【题目】碱性硼化钒(VB2)一空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用情性电极电解硫酸铜溶液,实验装置如图所示。下列说法正确的是

A. VB2电极的电极反应式为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中SO42-向b电极移动
D. 电解过程中,b电极表面有红色物质析出
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 氯气跟水反应:Cl2 + H2O= 2H++ Cl-+ ClO-
B. 食醋与氨水反应:NH3·H2O+H+= NH4++H2O
C. NaHCO3溶液中加少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D. 向Ba(OH)2溶液滴加NaHSO4溶液至Ba2+恰好沉淀:Ba2++2H++2OH-+SO42- = BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制0.5 mol·L-1的NaOH溶液490mL。实验室提供以下仪器:①烧杯 ②100 mL量筒 ③药匙 ④玻璃棒 ⑤托盘天平(带砝码)。请回答下列问题:
(1)计算结果:需要称取NaOH固体的质量为____________;
(2)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是 _______________、______________。(填仪器名称)
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)__________;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)实验两次用到玻璃棒,其作用分别是:先用于________、后用于________;
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是_______________;
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A
④加蒸馏水时不慎超过了刻度
(6)若实验过程中出现(5)中④这种情况你将如何处理?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是由A和CH2=CH2为主要原料合成的一种高分子酯类物质,合成路线如下(部分产物及条件已略去):
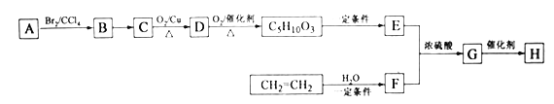
已知:①A的结构简式为: 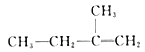
②E分子的核磁共振氢谱峰有4个,峰面积比为3:3:1:1.
(1)A的化学名称为__________
(2)F的结构简式为_________,B到C的反应条件是_________
(3)生成G的反应类型为_________,H的结构简式是_______,若H的平均相对分子质量为25600,则H的平均聚合度约为________
(4)C![]() D的化学方程式为_________
D的化学方程式为_________
(5)E有多种同分异构体,其中符合下列条件的同分异构体共有________种。
①能发生水解反应和银镜反应
②没有环状结构
③不含![]() 结构。
结构。
(6)写出以乙二醇为基本原料(其他试剂自选)合成聚乙二酸乙二酯的合成路线图(参照乙烯转化为F的格式)_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如右图所示。利用标签提供的信息,回答下列问题:
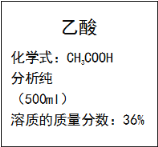
(1)乙酸的摩尔质量为______________。
(2)若该乙酸溶液的密度为1.02g/cm3,求此乙酸溶液的物质的量浓度_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com