
【题目】0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
科目:高中化学 来源: 题型:
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):

①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B 反应前总质量为 b g,反应后 A、B 的总质量为 c g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:_____________
(2)用 a、b、c 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:


(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. I 和 II 之间 C. II 和 III 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为_____。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有0.78 g Na2O2、1.68g NaHCO3的固体混合物放在密闭容器中加热,最后固体质量为_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是____________(填写编号);
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)当产生0.1 mol Cl2时,转移电子的数目为_____________;
(3)ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以同质量的物质得到的电子数多少来衡量)是Cl2的______倍(结果小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用足量的一氧化碳还原4.64 g某金属氧化物,把生成的二氧化碳全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此金属氧化物是下列中的( )
A. 氧化铜 B. 氧化铁 C. 四氧化三铁 D. 二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)一空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用情性电极电解硫酸铜溶液,实验装置如图所示。下列说法正确的是

A. VB2电极的电极反应式为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中SO42-向b电极移动
D. 电解过程中,b电极表面有红色物质析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1mol/LNaOH溶液分别滴加到0.1mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,下列说法不正确的是
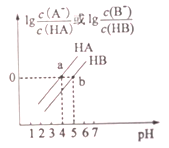
A. Ka(HB)<Ka(HA)
B. a点时,c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaA溶液的pH大于0.1mol/LNaB溶液的pH
D. 向HB溶液中加入NaOH溶液,混合溶液中c(B-)/c(HB)=10[pH-pKa(HB)](已知:pKa=-lgKa)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18纵行,下图中实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为下列几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自构造原理最后填入的电子的能级符号。
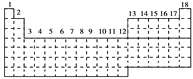
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影![]() 和
和![]() 表示d区和ds区____。
表示d区和ds区____。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在__________区。
(3)在元素周期表中4s轨道半充满的元素为__________(填元素符号)
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及其含硅化合物的重要原料。部分转化过程如图所示,下列说法正确的是

A. SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B. 因为在高温条件下二氧化硅与碳酸钠反应放出二氧化碳,所以H2SiO3的酸性比H2CO3强
C. SiO2在高温条件下能与过量的碳反应生成SiC,体现了二氧化硅的氧化性
D. 除Si的制取过程中涉及的反应外,图中所示其他反应都是非氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com