
【题目】在密闭容器中一定量混合气体发生反应:x A(g)+y B(g) ![]() z C(g)平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol/L,下列判断正确的是
z C(g)平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol/L,下列判断正确的是
A. 平衡向逆反应方向移动B. x+y<z
C. C的体积分数保持不变D. B的转化率降低
【答案】B
【解析】
x A(g)+y B(g) ![]() z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,而再达平衡时,测得A的浓度为0.20mol/L,则说明体积增大(压强减小)化学平衡正向移动,以此来解答。
z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,而再达平衡时,测得A的浓度为0.20mol/L,则说明体积增大(压强减小)化学平衡正向移动,以此来解答。
由信息可知,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时测得A的浓度为0.20mol/L,说明体积增大,相当于压强减小,化学平衡正向移动,则
A.由上述分析可知,平衡正向移动,A错误;
B.减小压强,向气体体积增大的方向移动,平衡正向移动,说明正反应为气体体积增大的反应,x+y<z,B正确;
C.将容器飞容积扩大为原来的2倍,平衡正向移动,则C的体积分数增大,C错误;
D.平衡正向移动,反应物B的转化率就会增大,D错误;
故合理选项是B。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】硒(Se)是动物必需的营养元素和植物有益的营养元素,可以形成SeO2、H2SeO3、H2SeO4等化合物。
(1)硒的原子结构示意图可表示为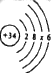 ,则x的值为_____。
,则x的值为_____。
(2)向亚硒酸溶液中通入二氧化硫,有单质硒析出,写出该反应的化学方程式: _______。
(3)已知:Se(s)+H2(g)+2O2(g)=H2SeO4(s) ΔH1;
H2(g)+![]() O2(g)=H2O(l) ΔH2;
O2(g)=H2O(l) ΔH2;
2SeO2(g)+O2(g)+2H2O(l)=2H2SeO4(s) ΔH3。
则反应Se(s)+O2(g)=SeO2(g)的ΔH=____。(用含ΔH1、ΔH2、ΔH3的代数式表示)
(4)温度为T℃时,向2.0L恒容密闭容器中充入1.0molH2SeO3(g),发生反应:H2SeO3(g)![]() SeO2(g)+H2O(g) △H=+a kJ/mol。0~10min保持容器中温度不变,10min时改变一种条件,整个过程中H2SeO3(g)、SeO2(g)、H2O(g)的物质的量随时间的变化如图所示:
SeO2(g)+H2O(g) △H=+a kJ/mol。0~10min保持容器中温度不变,10min时改变一种条件,整个过程中H2SeO3(g)、SeO2(g)、H2O(g)的物质的量随时间的变化如图所示:
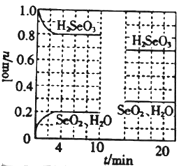
①要提高平衡时SeO2的体积分数,可采取的措施有______(填字母)。
a.容器体积不变,升高反应温度
b.使用高效催化剂
c.温度和容积不变,减小H2SeO3的起始量
d.温度不变,压缩容器体积,增大压强
②0~4min的平均反应速率v(H2O)=______;
③10min时改变的条件是_____;
④温度为T℃时,该反应的平衡常数K为______。若起始时向该容器中充入2.0mol H2SeO3(g)、1.0 mol SeO2(g)和0.15 mol H2O(g),反应达到平衡前,v(正)____(填“大于”“小于”或“等于”)v(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJmol1,
2H2(g)+O2(g)═2H2O(g) △H=484kJmol1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物 的系统命名是________________________________________________________________________,
的系统命名是________________________________________________________________________,
将其在催化剂存在下完全氢化,所得烷烃的系统命名是________________________________________________________________________。
(2)有机物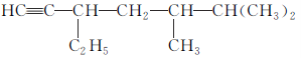 的系统命名是________________________________________________________________________,
的系统命名是________________________________________________________________________,
将其在催化剂存在下完全氢化,所得烷烃的系统命名是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素的基态价电子排布式为_____________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______________,提供孤电子对的成键原子是_____________。
③氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是__________________;氨是_________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______________键形成的晶体。
(4)某镍白铜合金的立方晶胞结构如图所示。
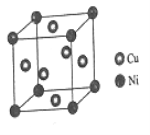
①晶胞中铜原子与镍原子的数量比为___________。
②若合金的密度为dg/cm3,晶胞边长a=______________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P-P键数目为4NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. 1mol FeI2与足量氯气反应时转移的电子数为2NA
D. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为6NA
组成的碳单质中所含质子数一定为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 根据如表所列数据判断,错误的是
根据如表所列数据判断,错误的是
元素 |
|
|
|
|
X | 496 | 4562 | 6912 | 9543 |
Y | 578 | 1817 | 2745 | 11575 |
A. 元素X的常见化合价是![]() 价
价
B. 元素Y是ⅢA族元素
C. X单质的熔点高于Y单质的熔点
D. 若元素X处于第3周期,它的单质可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解饱和食盐水的原理示意图如图所示。下列说法正确的是 ( )

A. M为负极
B. 通电使氯化钠发生电离
C. c出口收集到的物质是氯气
D. 电解一段时间后,阴极区pH降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com