
【题目】下列实验事实与图象对应正确的是( ) 
A.I表示向Na2SO3溶液中通入Cl2
B.II表示向纯CH3COOH中逐滴加水并不断振荡
C.III表示向KOH和Ca(OH)2混合液中通入CO2
D.Ⅳ表示向NaOH溶液中逐滴加入AlCl3溶液并不断振荡
【答案】D
【解析】解:A、Na2SO3溶液显碱性,通入氯气之前,其pH应大于7,故A错误;B、纯CH3COOH中氢离子浓度为0,故B错误;
C、二氧化碳与氢氧根离子反应生成碳酸根离子,与钙离子反应生成沉淀,生成沉淀应从0点开始产生沉淀,故C错误;
D、向NaOH溶液中逐滴加入AlCl3溶液,开始生成Na[Al(OH)4],NaOH反应完全后,Na[Al(OH)4]再与AlCl3反应生成Al(OH)3沉淀,与图象相符合,故D正确;
故选D.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是( )
A.澄清石灰水和稀盐酸混合
B.小苏打溶液和醋酸混合
C.盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合
D.氯化钠溶液和蔗糖水混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中,说法不正确的是
A.75.77%表示35Cl的质量分数B.24.23%表示37Cl的丰度
C.35. 453表示氯元素的相对原子质量D.36.966表示37Cl的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJmol﹣1 ,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=﹣657.01kJmol﹣1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=﹣625.63kJmol﹣1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
A.2.43×104 kJ
B.2.35×104 kJ
C.2.23×104 kJ
D.2.14×104 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块金属钠长期露置于空气中发生一系列变化,最终产物是( )
A. NaOH B. Na2CO3 C. Na2CO3·10H2O D. Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100g浓度为18mol/L的浓硫酸(密度为ρg/cm3)中加入一定量的水,稀释成9mol/L的硫酸,则加入水的体积为
A.小于100mLB.等于100mLC.大于100mLD.等于100/ρmL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3﹣和CN﹣的形式存在,工业上有多种废水处理方法. 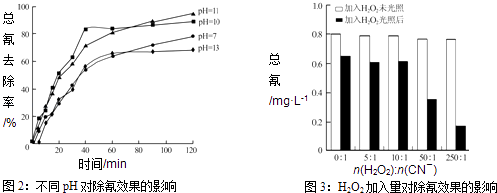
(1)电解处理法 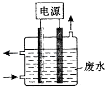
图1电源废水铁电极石墨电极
用图1所示装置处理含CN﹣废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO﹣将CN﹣氧化为无害物质而除去.铁电极为(填“阴极”或“阳极”),阳极产生ClO﹣的电极反应为 .
(2)UV(紫外光线的简称)﹣H2O2氧化法. 实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2 , 置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O,[Fe(CN)6]4﹣更稳定;
②[Fe(CN)6]3﹣转化为CN﹣容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
Ⅰ.废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是(用符号表示).
Ⅱ.K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应 .
Ⅲ.含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为(a.7﹣10;b.10﹣11;c.11﹣13),解释选择该pH范围的原因 .
Ⅳ.图3表示某pH时,加入不同量H2O2 , 处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN﹣)=250:1时,剩余总氰为0.16mgL﹣1 , 除氰率达80%,计算0﹣30min时间段反应速率v(CN﹣)=mgL﹣1min﹣1(结果保留两位有效数字).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com