
【题目】将2molX和0.8molY置于体积为2L的恒容密闭容器中,发生反应:2X(g)+Y(s)![]() M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
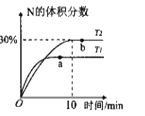
A.无论温度为T1还是T2,当容器中气体密度不变或压强不变时,反应达平衡状态
B.温度为T2时,X的平衡转化率为60%,平衡常数K=5.625
C.T1、T2的平衡常数分别为K1、K2,则K1<K2
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
【答案】C
【解析】
A.该反应前后气体计量数之和不变,则反应前后气体物质的量不变,恒温恒容时气体压强始终不变,反应前后气体物质的质量是个变值,不能根据压强判断平衡状态,恒温恒容时,气体的密度是个变值,可以根据气体密度不变判断平衡状态,故A错误;
B.温度为T2时,X的平衡转化率为60%,则消耗的n(X)=1mol/L×60%=0.6mol/L,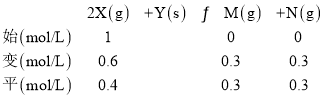
则K=![]() =0.5625,故B错误;
=0.5625,故B错误;
C.根据“先拐先平数值大”知,T1>T2,升高温度N的含量降低,则平衡逆向移动,逆反应方向为吸热反应,则该反应是放热反应,升高温度平衡常数减小,则T1、T2的平衡常数分别为K1、K2,则K1<K2,故C正确;
D.降低温度、及时分离出产物都使平衡正向移动,有利于提高反应物的平衡转化率,反应前后气体计量数之和不变,增大压强,平衡不移动,转化率不变,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为:![]() +CO2
+CO2![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.上述反应属于加成反应
B.碳酸亚乙酯的所有二氯代物中均存在手性碳原子
C.碳酸亚乙酯中的所有氧原子处于同一平面内
D.1mol碳酸亚乙酯最多可消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) △H=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
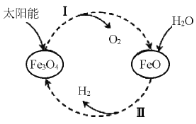
过程I:2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2 kJ/mol
过程II:……
下列说法不正确的是
A.过程I中每消耗232gFe3O4转移2mol电子:
B.过程II热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9 kJ/mol
C.过程I、II中能量转化的形式依次是:太阳能→化学能→热能
D.过程I中正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,万物之基。不仅如此,水在化学中的作用也不可忽视。
I.常温下,浓度均为0.l mol·L-1的下列五种水溶液的pH如下表:
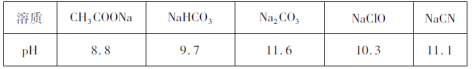
(1)上述盐溶液中的阴离子,结合质子能力最强的是__________。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最弱的是__________;将各溶液分别加水稀释100倍,pH变化最大的是__________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
(3)要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为__。
II.已知水在25℃和95℃时,其电离平衡曲线如图所示:
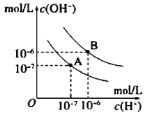
(1)95℃时水的电离平衡曲线应为__________(选填“A”或“B”);
(2)25℃时,将pH=10的NaOH溶液与pH=6的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为__________;
(3)95℃时,若1体积pH=a的某强酸溶液与10x体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
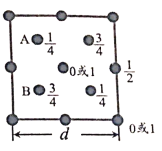
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值,下列说法错误的是
A.27 g 铝加入足量 1mol/L 的 NaOH 溶液,转移的电子数为 3NA
B.18g 氨基(-ND2)中含有的电子数为 10NA
C.向 100mL0.1mol/L 醋酸溶液中加 CH3COONa 固体至溶液刚好为中性,溶液中醋酸分子数为 0.01NA
D.用惰性电极电解 100mL0.1mol/L 的 CuSO4 溶液,当阴、阳两极产生相同条件下等体积的气体时, 电路中转移电子数为 0.04NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化中的能量转换对于生产具有重大意义和研究价值。回答下列问题:
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量__(填“释放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJmol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJmol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJmol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJmol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=__kJmol-1。
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。

①再生的CuCl2蚀刻液为流出液__(填“a”或“b”)。
②写出N极的电极反应:__。
③装置中使用___离子交换膜(填“阳”或“阴”)。若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol电子,流出液未流出时,两侧电解液的质量差为__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法,其流程如下图所示。已知向反应中得到的产物中加过量I2会得到两层溶液——含低浓度I2的H2SO4层和含高浓度I2的HI层,这两层分别进行反应Ⅱ和Ⅲ,循环分解制氢。下列说法错误的是( )
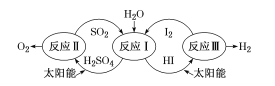
A.反应I的化学方程式为 SO2+2H2O+I2=H2SO4+2HI
B.该流程将太阳能转化为化学能,且降低了水分解制氢的活化能
C.H2SO4层和HI层在加I2之前和加I2之后均分成两层,且两层密度、颜色均不相同
D.SO2和I2是反应 2H2O =2H2+O2的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C.已知冰的熔化热为6.0kJ/mol,冰中氢键键能为20kJ/mol。假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com