
【题目】设 NA为阿伏加德罗常数的值,下列说法错误的是
A.27 g 铝加入足量 1mol/L 的 NaOH 溶液,转移的电子数为 3NA
B.18g 氨基(-ND2)中含有的电子数为 10NA
C.向 100mL0.1mol/L 醋酸溶液中加 CH3COONa 固体至溶液刚好为中性,溶液中醋酸分子数为 0.01NA
D.用惰性电极电解 100mL0.1mol/L 的 CuSO4 溶液,当阴、阳两极产生相同条件下等体积的气体时, 电路中转移电子数为 0.04NA
【答案】B
【解析】
A.27 g 铝为1mol,加入足量 1mol·L-1 的 NaOH 溶液,生成NaAlO2和H2,1molAl失去3mol电子,转移的电子数为 3NA,故A正确;
B.18g 氨基(-ND2)中含有的电子数为![]() = 9NA,故B错误;
= 9NA,故B错误;
C.向100mL0.1mol/L 醋酸溶液中加 CH3COONa 固体至溶液刚好为中性,根据电荷守恒,溶液中c(Na+)=c(CH3COO-),溶液中醋酸分子数为0.100L×0.1mol·L-1NA= 0.01NA,故C正确;
D.用惰性电极电解100mL0.1mol·L-1的CuSO4溶液,阴极上Cu2+先放电生成0.01molCu,而后H+放电生成H2,阳极上一直是OH-放电生成O2,设生成的气体的物质的量为xmol,根据两极上得失电子数守恒可知:0.01mol×2+2x=4x,解得x=0.01mol,故阳极上转移电子为0.04NA个,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)![]() 溶液显酸性,试用离子方程式解释其原因________。
溶液显酸性,试用离子方程式解释其原因________。
(2)氯化银在水中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),在25C时,氯化银的![]() ,现将足量氯化银分别放入:①
,现将足量氯化银分别放入:①![]() 氯化镁溶液中,②
氯化镁溶液中,②![]() 硝酸银溶液中,③
硝酸银溶液中,③![]() 氯化铝溶液中,④
氯化铝溶液中,④![]() 盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
(3)下表所示的是常温下,某些弱酸的电离常数,请根据要求作答。
弱酸 | 电离常数 | 弱酸 | 电离常数 |
|
|
|
|
|
|
|
|
①相同物质的量浓度的![]() 和
和![]() 的混合溶液中离子浓度由大到小的顺序为_________。
的混合溶液中离子浓度由大到小的顺序为_________。
②请判断![]() 溶液显_________性(填“酸”、“碱”或“中”)。
溶液显_________性(填“酸”、“碱”或“中”)。
③下列离子方程式书写正确的是_______。
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
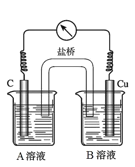
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
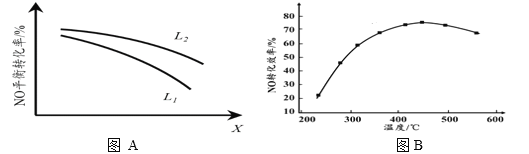
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molX和0.8molY置于体积为2L的恒容密闭容器中,发生反应:2X(g)+Y(s)![]() M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
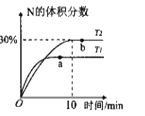
A.无论温度为T1还是T2,当容器中气体密度不变或压强不变时,反应达平衡状态
B.温度为T2时,X的平衡转化率为60%,平衡常数K=5.625
C.T1、T2的平衡常数分别为K1、K2,则K1<K2
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用,其中铁和铜是两种应用广泛的元素。
(1)基态铁原子的价电子轨道表达式为_____。
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是_____,1mol 尿素分子中含有的 σ 键数目为_____。 CH3COONa 中碳原子的杂化类型为_________。
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是_____,写出与CO互为等电子体的分子的电子式_____(任写一种)。
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因_____。
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:
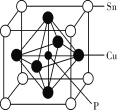
①其化学式为_____。
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为_____pm(用含 NA 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子核外电子的描述正确的是
A.s 能级的能量总小于 p 能级的能量
B.2s 的电子云半径比 1s 电子云半径大,说明 2s 的电子比 1s 的多
C.基态铜原子的价电子轨道表示式为 ![]()
D.nf 能级中最多可容纳 14 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用 R代表)。 回答下列问题:
(1)基态氮原子价层电子的轨道表示式为_____。
(2)氯离子的基态电子排布式为_____,有_____种不同能级的电子。
(3)R 中 H、N、O 三种元素的电负性由大到小的顺序是_____(用元素符号表示)。
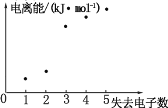
(4)如图表示短周期元素 X 的基态原子失去电子数与对应电离能的关系,试推测 X 与R 中的_____(填元素符号)元素同周期。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A和B的相对分子质量都小于200,完全燃烧时只生成CO2和H2O。B燃烧时消耗的氧气与生成的二氧化碳的物质的量相等。B中碳、氢元素总的质量分数为46.67%。B不发生银镜反应,但跟NaHCO3溶液反应放出CO2。1molA水解生成1mol苯甲酸和1molB。A溶液具有酸性,但遇FeCl3溶液不显色。
(1)A与B相对分子质量之差为___。
(2)B分子中应有___个氧原子。
(3)A的结构简式为___或___。
(4)写出B的属于酯的四种同分异构体的结构简式___、___、___、___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com