
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
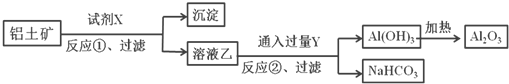
A. 反应①中试剂X是氢氧化钠溶液
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应中包含一个氧化还原反应
D. 将试剂X和Y进行对换,最终可以达到相同的效果
【答案】A
【解析】
Al2O3、Fe2O3都和硫酸反应,要将Al2O3和Fe2O3分离出来,可利用氧化铝的两性,用NaOH溶液将其溶解为偏铝酸钠,则固体难溶物是Fe2O3,然后向偏铝酸钠溶液中通二氧化碳制得Al(OH)3沉淀,发生CO2+AlO2-+2H2O= Al(OH)3↓+HCO3-,氢氧化铝加热分解产生氧化铝,电解熔融氧化铝可得金属铝。
A.由上述分析可知试剂X为氢氧化钠溶液,A正确;
B.氧化铁与氢氧化钠不反应,所以反应①后过滤得到沉淀为氧化铁,B错误;
C.反应①、②是复分解反应,氢氧化铝变为氧化铝的反应为分解反应,不包含氧化还原反应,C错误;
D.由上述分析可知,X为NaOH,Y是CO2,将试剂X和Y进行对换,①不能分离氧化铁、氧化铝,不能达到相同效果,D错误;
故合理选项是A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.实验室常用MnO2与浓盐酸反应制备Cl2(装置如图所示)。

(1)制备实验开始时,先检査装置气密性,接下来的操作依次是:_______(填序号)。
①往烧瓶中加入MnO2粉末;②加热;③往烧瓶中加入浓盐酸
(2)写出圆底烧瓶中发生反应的离子方程式_______________________。
(3)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法_______(填字母序号)。
a.将Cl-转化为AgCl沉淀,过滤,洗涤,干燥,称量沉淀的质量
b.与足量NaHCO3固体反应,将反应后气体直接用碱石灰吸收,测定生成气体的质量
c.与足量锌反应,测量生成气体标准状况下的体积
II.为测定某亚硫酸钠样品纯度,研究小组利用如下装置(装置图中夹持仪器已省略)进行实验。
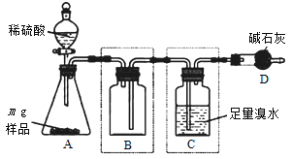
反应完全后,向C中溶液加入过量BaCl2溶液,过滤、操作①、干燥、称量,利用所得数据计算样品纯度。请回答:
(4)操作①的名称是____________。
(5)装置B的作用是______________________。
(6)最终所得固体质量为b g,则该样品中亚硫酸钠的质量分数为____________(用含字母m、b的代数式表示)。
(7)上述实验测得的样品纯度比实际偏低,为提高测定结果的准确度,可采取的改进措施是________________________________________(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)甲醇是重要的化工原料,CO和CO2均可用于合成甲醇。用CO2来生产甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
(1)已知:
2CO(g)+O2(g)=2CO2(g) △H2
2H2(g)+O2(g)=2H2O(g) △H3
则CO(g)+ 2H2(g)=CH3OH(g) △H4=_______
(2)由CO合成甲醇时,CO的平衡转化率与温度和压强的关系如图所示。P点和Q点的平衡常数的大小KP____ KQ (填“大于”、“小于”或“等于”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________________。

(3)一定温度下,向2 L密闭容器中加入1 mol CH3OH(g),发生反应CH3OH(g) =CO(g)+ 2H2(g),CO的体积分数随时间的变化如图所示。

①反应达到平衡状态的标志是___________。
A.气体的密度不变
B.气体的压强保持不变
C.υ正(CH3OH)=2υ正(H2)
D.υ正(H2)=2υ逆(CO)
②该温度下,CO(g)+ 2H2(g)=CH3OH(g)的平衡常数K=_________。
③若在t1时刻再加入1mol CH3OH(g),在t2 时刻重新达到平衡,请在图上画出CO的体积分数随时间变化的曲线(不要求计算具体数值,画出变化的趋势和范围即可)_______。
(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。负极的电极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如下图所示的转化关系,下列判断错误的是

A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则Z可能是NaAlO2
B. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
C. 若图中反应均为非氧化还原反应,当W为一元强酸时则X可能是NH3
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )
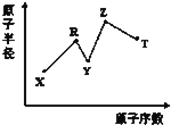
A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A. 0.1 mol![]() 所含电子的数目为1.4NA
所含电子的数目为1.4NA
B. 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 14gLi在空气中充分燃烧,消耗氧分子的数目为NA
D. 标准状况下,11.2LCl2溶于水,溶液中Clˉ、ClOˉ和HClO的微粒数之和小于NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com