
【题目】能把乙醇、乙酸、葡萄糖溶液用一种试剂区别开,这种试剂是( )
A.新制氢氧化铜B.溴水C.银氨溶液D.酸性KMnO4溶液
科目:高中化学 来源: 题型:
【题目】X+的核外电子数分别为2、8、8,则X元素在周期表中的位置是( )
A. 第三周期第0族 B. 第四周期第ⅠA族
C. 第三周期第ⅠA族 D. 第三周期第ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲烷(CH4)和白磷(P4)分子的空间结构示意图,请把你认为是化学键的虚线改为实线,把碳原子涂成实心小圆点(在图上改即可__________)。甲烷分子是________(填“左”、“右”)图。从图中看出,每个甲烷分子中有________对共用电子,而白磷分子中形成______个共价键,键角为________。甲烷是由________键(填“极性”或“非极性”,下同)形成的________分子,白磷是由________键形成的________分子。
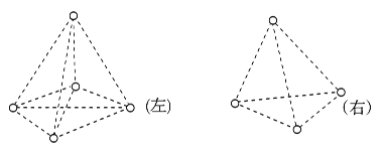
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是
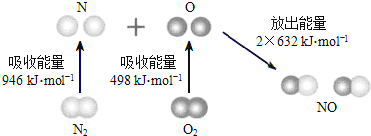
A.N2(g)与O2(g)反应生成NO(g)是放热反应
B.2molO原子结合生成O2(g)时需要放出498kJ能量
C.1molNO(g)分子中的化学键断裂时需要放出632kJ能量
D.N2(g)+O2(g)=2NO(g)△H=+1444kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
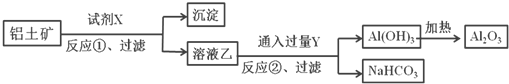
A. 反应①中试剂X是氢氧化钠溶液
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应中包含一个氧化还原反应
D. 将试剂X和Y进行对换,最终可以达到相同的效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电于数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
(1)B在元素期表中的位置为_______,1个C原子核外有____个未成对的电子。
(2)D、E、F三种元素形成简单离子其半径由l大到小的顺序是_____________。(用离子符号表示)。
(3)写出D与C形成化合物的电子式______、_______。
(4)常温下,1molA的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为______________。
(5)非金属性的强弱:E_____F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因________________。
(6)Na2SO3可用作漂白织物时的去鼠剂。Na2SO3溶液及收Cl2后,溶液的酸性增强。写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年7月报道,南开大学科研团队在“可充室温钠-二氧化碳电池”的研究中取得突破进展,该电池放电时工作情况如图所示。下列说法错误的是

A. 金属Na为电池的负极
B. 放电时,电解液中Na+向碳电极移动
C. 充电时,碳电极发生的反应为:4Na++4e-+3CO2== 2Na2CO3+C
D. 放电时,每转移2 mol电子,消耗标准状况下的CO2 33.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是宇宙中含量最高的元素,占宇宙总质量的75%,应用前景十分广阔。
(1)氢有1H、2H、3H三种常见的核素,它们互称为____;氢元素的相对原子质量约为1.008,则三种核素中丰度(百分含量)最高的是____。
(2)2H2O可用作核反应堆的减速剂,1个 2H2O分子中所含中子的个数为___。
(3)H可与N形成多种分子,其中某分子含18个e-、6个原子,则该分子的结构式为__。
(4)工业上用C和H2O制取H2。已知:
①C(s) + H2O(g) = H2(g) + CO(g) ΔH1 ②C(s) + 2H2O(g) = 2H2(g) + CO2(g) ΔH2
则CO(s) + H2O(g) = H2(g) + CO2(g) ΔH =__(用ΔH1、ΔH2表示)。
(5)NaBH4是一种重要的储氢载体。
①B在元素周期表中的位置为___。
②NaBH4(s)与H2O (l)反应生成NaBO2(s)和一种气体,在25℃,101kPa下,已知每消耗3.8g NaBH4放热21.6kJ,则该反应的热化学方程式为________;反应前后B的化合价不变,则反应消耗1molNaBH4时转移的电子数目为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com